- Amélioration bilatérale durable, cliniquement significative, des fonctions visuelles 96 semaines après l’injection
- L’amélioration bilatérale observée est interprétée comme largement supérieure à l’histoire naturelle connue de la maladie
- Les améliorations de la fonction visuelle se traduisent par une amélioration significative de la qualité de vie chez les patients atteints de NOHL
- GenSight s’apprête à déposer une demande d’AMM pour GS010, d’abord en Europe et ensuite aux États-Unis
Paris, France, le 29 mai 2019, 7h30 CEST – GenSight Biologics (Euronext : SIGHT, ISIN : FR0013183985, éligible PEA-PME), société biopharmaceutique dédiée à la découverte et au développement de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central, publie aujourd’hui les principaux faits marquants de la réunion de leaders d’opinion (KOL) qui s’est tenue à New York le 23 mai 2019. L’événement était consacré aux derniers résultats cliniques de GS010, et en particulier aux observations à 96 semaines de l’étude clinique de Phase III REVERSE dans le traitement de la Neuropathie Optique Héréditaire de Leber (NOHL).
Le panel d’experts médicaux était composé des Drs. David J. Calkins, PhD [1] ; Sean Donahue, PhD [2] ; Mark Moster[3] ; José-Alain Sahel[4] ; et Robert C. Sergott5. Par ailleurs, Andy Marks, un patient atteint de NOHL et défenseur des droits des patients, a parlé de son expérience avec la NOHL.
Le Dr Donahue a démarré la discussion matinale par une présentation de la NOHL en tant que maladie génétique. Le Dr Moster a ensuite fait une analyse critique de la littérature relative à l’évolution de la vision après la perte brutale initiale, tout au long de l’histoire naturelle de la maladie. Le Dr Moster a souligné les différences au sein de la population étudiée, en termes de mutations en cause, et de la date d’apparition de la maladie dans les études précédentes. Ses analyses, qui tentaient de tenir compte des facteurs ci-dessus, montrent qu’il existe une « énorme différence » entre les résultats obtenus dans l’étude REVERSE et les résultats publiés dans la littérature médicale.
Tout aussi important, son expérience clinique et celle de ses pairs sont contraires aux améliorations durables observées dans l’étude REVERSE. « Les types d’amélioration observés dans cette étude sont bien supérieurs à ce que nous voyons dans notre pratique clinique, » a conclu le Dr Moster. Il a rappelé à l’auditoire que les patients de l’étude REVERSE étaient porteurs de la mutation la plus grave en termes de taux de guérison spontanée.
Andy Marks a expliqué que la détérioration visuelle a des conséquences importantes sur la vie des patients. Il a décrit comment il avait dû renoncer à la maison qu’il venait d’acheter lorsque sa vue a commencé à baisser à cause de la NOHL, et qu’il a dû déménager plus près de son bureau pour s’adapter à sa perte d’autonomie. Il a ensuite quitté Orlando pour habiter dans la région de New York, où il serait moins pénalisé dans sa vie professionnelle par son incapacité à conduire. Parmi les autres patients de la communauté de la NOHL au sein de laquelle il est activement impliqué, il n’a encore rencontré personne dont les fonctions visuelles ont retrouvé le niveau décrit dans l’étude REVERSE, après l’apparition de la maladie.
« Nous vivons une époque où les thérapies géniques permettent des résultats remarquables », a déclaré le Dr Sergott, qui a rappelé les principales observations de l’étude REVERSE. Parmi les résultats sur l’efficacité, il a qualifié d’« extraordinaire » la récupération de l’acuité visuelle, de +15 lettres ETDRS comparée à la baseline, et de +28 lettres ETDRS comparée au nadir pour les yeux traités par GS010, contre +13 et +23, respectivement, pour les yeux sham (ayant reçu une injection simulée).
Le Dr Sergott a également partagé des données disponibles depuis peu, recueillies à la Semaine 96, qui ont montré que :
- Chez la plupart des patients, les deux yeux tendaient à évoluer ensemble, de manière bilatérale ;
- Une amélioration bilatérale a été observée chez la plupart des patients, comparée à la baseline ;
- Chez les patients ayant obtenu une amélioration importante par rapport à la baseline et au nadir, l’acuité visuelle de l’œil traité par GS010 avait tendance à être supérieure à celle de l’œil sham ;
- Chez un nombre plus important de patients, l’amélioration par rapport au nadir était plus importante dans l’œil traité par GS010.
Figure 1. Evolution de l’acuité visuelle à 96 semaines par rapport à la baseline en LogMAR chez les sujets de l’étude REVERSE
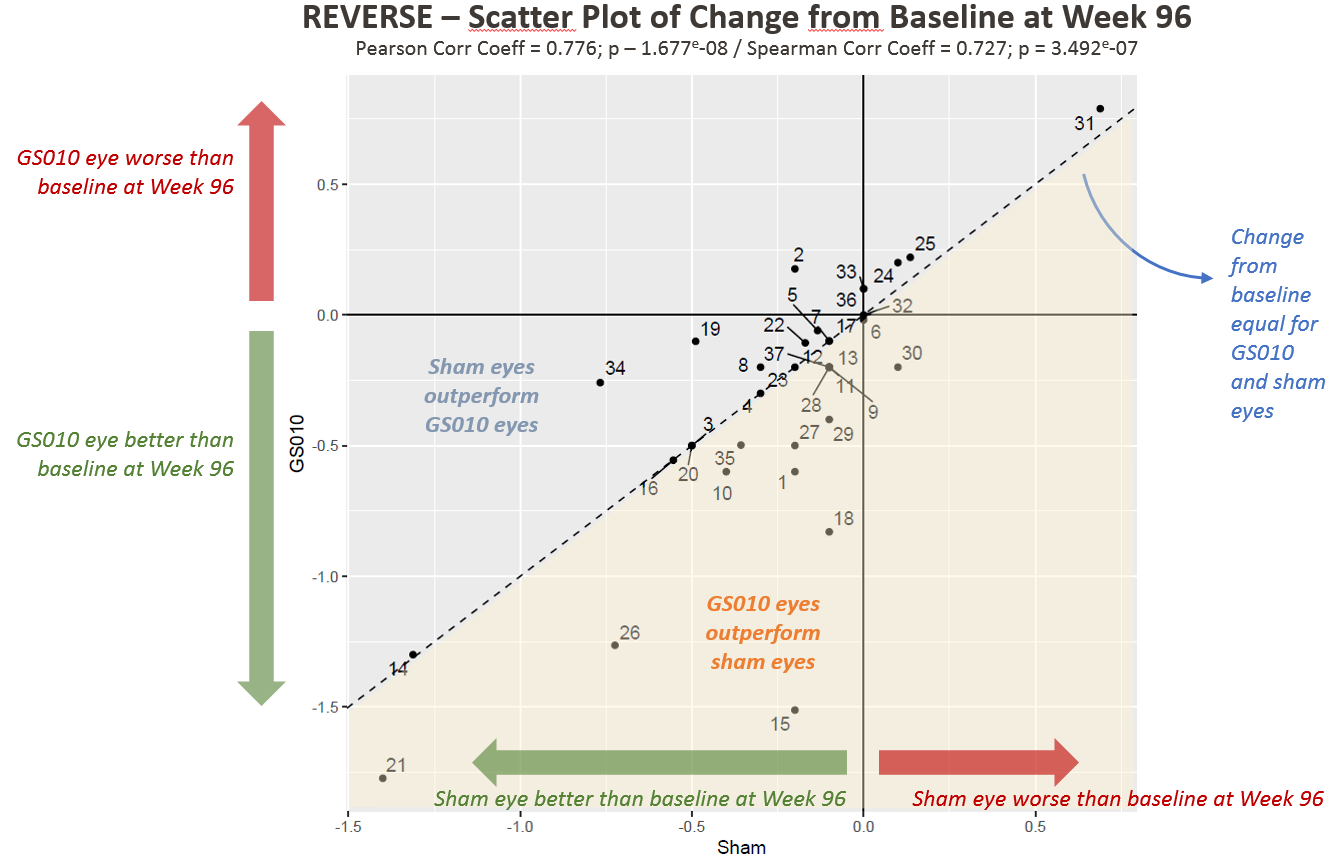
Figure 2. Evolution de l’acuité visuelle à 96 semaines par rapport au nadir en LogMAR chez les sujets de l’étude REVERSE
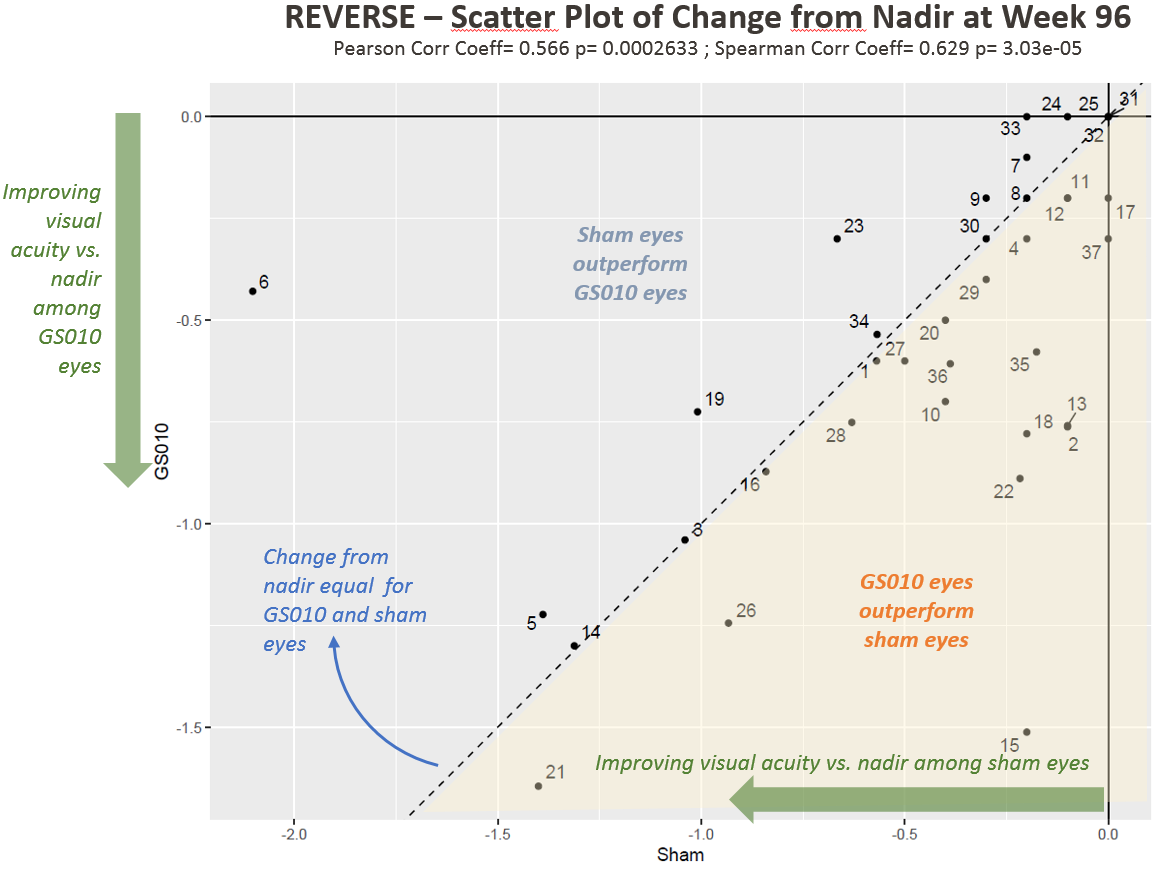
À noter : Chaque point des Figures 1 et 2 représente un patient (deux yeux) dans l’étude REVERSE.
L’amélioration bilatérale était donc vérifiée pour les données individuelles des patients, et pas uniquement le résultat de données agrégées. La présentation du Dr Calkins était dédiée à cette amélioration bilatérale durable, en contradiction avec l’évolution naturelle de la maladie ou la pratique clinique connue. Il a d’abord reconnu qu’il aurait été surpris s’il n’y avait eu aucun effet sur l’œil controlatéral. Il a ensuite expliqué qu’un œil peut interagir avec et compenser une faiblesse de son œil controlatéral de nombreuses manières. Il a déclaré que « l’œil controlatéral devait nécessairement s’améliorer. »
L’équipe du Dr Calkins étudie comment, suite à un stress dans un œil, l’autre œil (non stressé) peut partager ses ressources énergétiques et métaboliques via le nerf optique. Le Dr Calkins a suggéré que ce phénomène de compensation entre les yeux pourrait être dû aux réseaux formés entre les astrocytes et les neurones au niveau de la rétine et du nerf optique, ce qui leur permet de partager des molécules métaboliques. « Ces ressources peuvent voyager via les réseaux d’astrocytes, de l’œil traité à l’œil non traité pour améliorer la performance globale, » a conclu le Dr Calkins. Il est nécessaire de se rappeler que GS010 agit en restaurant la capacité des mitochondries des cellules ganglionnaires de la rétine à générer l’énergie nécessaire pour le traitement visuel.
Le Dr Sahel, co-fondateur de GenSight, a résumé les présentations en réitérant les observations d’efficacité et en rejetant un « effet placebo » ou un « effet d’entraînement » pour expliquer ces résultats. Il a ajouté qu’il serait difficile de réconcilier l’évolution bilatérale des yeux des sujets avec un « effet placebo » ou un « effet d’entraînement ». « Comment un effet placebo ou d’entraînement pourrait-il avoir un effet similaire à la baisse initiale d’un signal d’efficacité [effet nadir observé dans les études REVERSE et RESCUE] suivie d’une amélioration continue par la suite ? Comment l’effet placebo ou d’entraînement pourrait-il avoir un tel effet ? C’est très improbable, » a-t-il expliqué. « Ces résultats surprenants sont une bonne nouvelle pour les patients. »
Le Dr Donahue a conclu en partageant l’expérience d’un patient adolescent traité par GS010 dans le cadre d’un programme d’accès compassionnel. « Il est passé d’un stade où il avait besoin de l’aide de ses parents pour traverser une pièce à pouvoir jouer à nouveau au basket. Ce n’est certes l’expérience que d’un patient, mais vous noterez que ces résultats sont très impressionnants et la famille est très reconnaissante. »
A l’issue de ces discussions, Bernard Gilly, Directeur Général et co-fondateur de GenSight Biologics, a souligné la détermination de la Société à commercialiser GS010 le plus tôt possible. « L’équipe prépare activement la réunion de pré-soumission avec l’EMA, ainsi que la réunion de fin de Phase 2 avec la FDA afin d’entamer le processus réglementaire d’autorisation de GS010. »
La présentation est accessible en replay sur le site web de la Société, à l’adresse suivante : https://www.gensight-biologics.com/fr/2019/05/22/presentation-investisseurs-des-resultats-cliniques-de-phase-3-de-gs010-pour-le-traitement-de-la-neuropathie-optique-hereditaire-de-leber-nohl-new-york/.
[1] Prof. O’Day, Vice-président et Directeur de la Recherche au Vanderbilt Eye Institute, Vanderbilt University Medical Center, Nashville, TN
[2] Professeur Coleman d’Ophtalmologie, Neurologie et Pédiatrie ; Vice-président des Affaires Cliniques, Ophthalmology Vanderbilt University Medical Center, Nashville, TN
[3] Neuro-Ophtalmologie, Wills Eye Hospital et Professeur de Neurologie et d’Ophtalmologie, Thomas Jefferson University, Philadelphie, PA
[4] Directeur de l’Institut de la Vision (Université de la Sorbonne/Inserm/CNRS), Paris ; Président du Département d’Ophtalmologie au Centre Hospitalier National d’Ophtalmologie des Quinze-Vingts, Paris ; Professeur et Président du Département d’Ophtalmologie de la Faculté de médecine de l’Université de Pittsburgh et UPMC (University of Pittsburgh Medical Center). Co-fondateur, GenSight.
5 Directeur, Neuro-Ophtalmologie, Wills Eye Hospital ; Directeur, William H. Annesley, Jr, EyeBrain Center, et Professeur de Neurologie et d’Ophtalmologie, Thomas Jefferson University, Philadelphie, PA
À propos de GenSight Biologics
GenSight Biologics S.A. (GenSight Biologics) est une société biopharmaceutique dédiée à la découverte et au développement de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central. Le portefeuille de recherche de GenSight Biologics s’appuie sur deux plates-formes technologiques : le ciblage mitochondrial (Mitochondrial Targeting Sequence, ou MTS) et l’optogénétique, visant à préserver ou restaurer la vision chez les patients atteints de maladies neurodégénératives de la rétine. Le candidat médicament le plus avancé de GenSight Biologics, GS010, est en Phase III pour le traitement de la neuropathie optique héréditaire de Leber (NOHL), une maladie mitochondriale rare qui conduit à une perte irréversible de la vue chez les adolescents et les jeunes adultes. En utilisant son approche de thérapie génique, les candidats médicaments de GenSight Biologics sont destinés à offrir aux patients une récupération visuelle fonctionnelle durable après une seule injection intra-vitréenne dans chaque œil.
À propos de GS010
GS010 cible la neuropathie optique héréditaire de Leber (NOHL), et s’appuie sur une technologie propriétaire de séquence de ciblage mitochondrial (MTS), issue des travaux de l’Institut de la Vision, qui, lorsqu’elle est associée au gène d’intérêt, permet de l’adresser spécifiquement à l’intérieur de la mitochondrie grâce à un vecteur AAV (Adeno-Associated Virus). Le gène d’intérêt est ainsi transféré dans la cellule pour y être exprimé et produire la protéine fonctionnelle, qui sera acheminée à l’intérieur des mitochondries grâce aux séquences nucléotidiques spécifiques, afin de restaurer la fonction mitochondriale déficiente ou manquante.
À propos de la Neuropathie Optique Héréditaire de Leber (NOHL)
La neuropathie optique héréditaire de Leber (NOHL) est une maladie mitochondriale rare, de transmission maternelle, caractérisée par une dégénérescence des cellules ganglionnaires de la rétine et provoquant en moins d’un an une perte brutale et irréversible de la vision conduisant généralement à la cécité légale. Ces symptômes apparaissent principalement chez les adolescents et les jeunes adultes. La NOHL provoque une perte brutale, soudaine et sans douleur de la vision centrale dans le 1er œil, puis le 2nd œil est atteint à son tour, de manière irréversible. 97% des patients présentent une perte bilatérale de la vision en moins d’un an, et cette perte de vision est simultanée dans 25% des cas. La NOHL causerait la cécité visuelle chez environ 1 400 à 1 500 personnes par an aux Etats-Unis et en Europe.
À propos de RESCUE et REVERSE
RESCUE et REVERSE sont deux études distinctes de Phase III randomisées, en double masqué, contrôlées par injection simulée (sham), conçues pour évaluer l’efficacité d’une injection intravitréenne unique de GS010 (rAAV2/2-ND4) chez des sujets atteints de la NOHL induite par la mutation G11778A ND4.
Le critère d’évaluation principal mesurera la différence d’efficacité de GS010 entre les yeux traités et les yeux non-traités (sham), sur la base de l’acuité visuelle (Best Corrected Visual Acuity ou BCVA), mesurée à l’aide de l’échelle ETDRS à 48 semaines après injection. Les scores « Logarithm of the Minimal Angle of Resolution » des patients, ou LogMAR, qui sont dérivés du nombre de lettres lues sur l’échelle ETDRS, seront utilisés à des fins statistiques. Les deux études ont été conçues pour évaluer une différence statistiquement significative d’au moins 15 lettres ETDRS entre les yeux traités et non-traités (sham), ajustés de l’acuité visuelle initiale (baseline).
Les critères d’évaluation secondaires incluront l’application de l’analyse principale aux yeux ayant reçu GS010 et présentant à l’inclusion la meilleure acuité visuelle initiale (« meilleur œil »), comparés à ceux ayant reçu la procédure sham, ainsi qu’aux yeux ayant reçu GS010 et présentant la moins bonne acuité visuelle initiale (« moins bon œil »), comparés à ceux ayant reçu la procédure sham. Également, une évaluation de la proportion de patients « répondeurs » sera réalisée, incluant notamment le pourcentage de patients qui maintiennent leur acuité visuelle (perte de moins de 15 lettres ETDRS), le pourcentage de patients qui améliorent leur acuité visuelle de 15 lettres ETDRS ou plus, ainsi que le pourcentage de patients présentant une acuité visuelle finale >20/200, ou 1/10. Les paramètres visuels mesurés incluront également les champs visuels automatisés, la tomographie par cohérence optique, ainsi que la sensibilité aux couleurs et aux contrastes, en plus des mesures de qualité de vie, de bio-dissémination, et de réponse immunitaire post-injection.
Les études sont actuellement menées en parallèle, chez 37 patients pour REVERSE et 39 patients pour RESCUE, dans 7 centres aux États-Unis, au Royaume-Uni, en France, en Allemagne et en Italie. Les résultats à 96 semaines de suivi des deux études sont attendus en 2019. Les patients seront ensuite transférés vers une étude de suivi à long terme pour 3 années supplémentaires.
Identifiants ClinicalTrials.gov :
REVERSE : NCT02652780
RESCUE : NCT02652767
Contacts
-
Orpheon FinanceInvestisseurs ParticuliersJames Palmer+33 7 60 92 77 74