- Maintien d’un gain d’acuité visuelle cliniquement significatif à 2,5 ans de suivi chez les patients atteints depuis moins de 2 ans
- Confirmation du bon profil de sécurité de GS010 à long terme
Paris, le 5 décembre 2017, 7h30 CET – GenSight Biologics (Euronext : SIGHT, ISIN : FR0013183985, éligible PEA-PME), société biopharmaceutique dédiée à la découverte et au développement de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central, annonce aujourd’hui des résultats de suivi à 2 ans et demi de son étude de phase I/II avec GS010, chez des patients atteints de la Neuropathie Optique Héréditaire de Leber (NOHL). Ces résultats confirment le maintien d’un gain d’acuité visuelle à long terme après 2 ans et demi chez les patients ayant reçu une unique injection intra-vitréenne de GS010, et en particulier chez ceux présentant une perte d’acuité visuelle depuis moins de 2 ans.
Dans l’étude, cinq groupes de trois patients ont reçu une dose croissante de GS010 par injection intra- vitréenne unique dans l’œil le plus sévèrement atteint par la pathologie. Le recrutement de 15 patients s’est achevé en avril 2015 et le suivi à long terme est en cours. En moyenne, ces patients avaient débuté la perte de vision 6 ans avant traitement. Avant injection, les yeux traités (TE) et non traités (UTE) présentaient tous une acuité visuelle médiane dite « off-chart ».1
2 ans et demi après l’injection, on observe chez les patients présentant une perte d’acuité visuelle depuis moins de 2 ans, et une vision relativement meilleure au moment de l’injection (<2,79 LogMAR),2 un gain moyen d’acuité visuelle par rapport à la baseline de +28 lettres ETDRS (-0,55 LogMAR) dans l’œil traité et de +13 lettres ETDRS (-0,25 LogMAR) dans l’œil non traité. La différence de 15 lettres ETDRS en faveur de l’œil traité est cliniquement significative, et l’amplitude de l’amélioration, similaire à la tendance observée à 48, 78 et 96 semaines, suggère un bénéfice durable de GS010.
Évolution de l’acuité visuelle de l’œil traité et de l’œil non traité après 2 ans et demi de suivi, chez les patients atteints depuis moins de 2 ans et une baseline < 2,79 LogMAR*
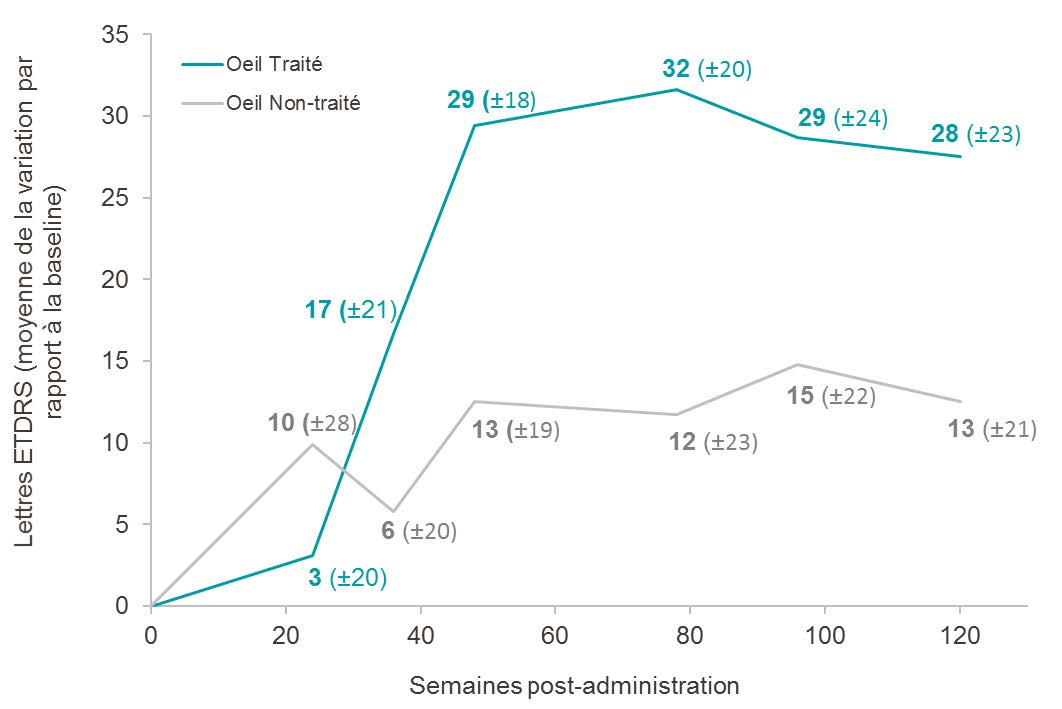
* Exclut les patients « hand motion », conformément au protocole de Phase III.
Le groupe de patients atteints d’une perte de vision depuis 2 ans ou moins et présentant une acuité visuelle relativement meilleure au moment de l’injection (<2,79 LogMAR) (n=5) présente une tendance pharmacologique durable en faveur de l’œil traité, d’amplitude croissante à partir de la semaine 36, avec pour 60 % d’entre eux un gain moyen cliniquement significatif ≥ 15 lettres à 2 ans et demi.3 Les caractéristiques de ce groupe de patients sont similaires aux caractéristiques de baseline des patients atteints de NOHL recrutés dans les essais cliniques de Phase III en cours, REVERSE et RESCUE.4
On observe dans l’œil traité de l’ensemble des patients (n=14) un gain moyen d’acuité visuelle par rapport à la baseline de +29 lettres ETDRS (-0,58 LogMAR) à la fois cliniquement et statistiquement significatif (p = 0,0034), tandis que l’œil non traité montre une amélioration moyenne de +22 lettres ETDRS (-0.44 LogMAR) par rapport à la baseline, qui n’est pas statistiquement significative. La différence de +7 lettres ETDRS est en faveur de l’œil traité.
2 ans et demi après l’injection, GS010 continue de démontrer un profil de sécurité et de tolérance favorable, en l’absence de toute incidence de détérioration de l’acuité visuelle ou de séquelle oculaire, d’effets indésirables graves liés au traitement (TEAEs), ou d’effets indésirables systémiques (AEs) liés au médicament ou au protocole. Conformément aux résultats reportés précédemment, les effets indésirables oculaires sont essentiellement mineurs, bien tolérés et entièrement réversibles, répondant au traitement standard.
Bernard Gilly, Directeur Général et cofondateur de GenSight Biologics, a déclaré : « Nous observons un bénéfice clinique significatif chez les patients récemment diagnostiqués, mais également que ce bénéfice est durable, deux ans et demi après une injection unique de GS010. C’est particulièrement encourageant, alors que nous sommes désormais à moins de 6 mois des données d’efficacité de phase III des études RESCUE et REVERSE. »
Dr. Catherine Vignal, investigateur de l’étude et Chef du service d’ophtalmologie de la Fondation Ophtalmologique A. de Rothschild, a ajouté : « Le profil de sécurité et les tendances positives observées se confirment après deux ans et demi de suivi, et constituent un espoir important pour les patients atteints de NOHL. Il est intéressant de noter que l’amélioration observée dans certains yeux non traités vient corroborer plusieurs études précédentes dans d’autres maladies neurodégénératives de la rétine. Les enseignements tirés de ces résultats, et de ceux à venir, seront déterminants dans le développement par GenSight d’une thérapie pour cette terrible maladie cécitante, touchant des patients très jeunes, et pour laquelle aucun traitement curatif n’existe à ce jour. »
GenSight Biologics conduit actuellement deux études cliniques de Phase III (RESCUE et REVERSE) en Europe et aux États-Unis pour évaluer l’efficacité de GS010 chez des sujets atteints de la NOHL induite par la mutation de ND4, et ayant subi une perte d’acuité visuelle depuis moins d’un an. Le recrutement s’est achevé en février 2017 pour REVERSE, et en août 2017 pour RESCUE. Les résultats préliminaires après 48 semaines sont attendus aux 2ème et 3ème trimestres 2018, respectivement.
À propos de GenSight Biologics
GenSight Biologics S.A. (GenSight Biologics) est une société biopharmaceutique dédiée à la découverte et au développement de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central. Le portefeuille de recherche de GenSight Biologics s’appuie sur deux plates-formes technologiques : le ciblage mitochondrial (Mitochondrial Targeting Sequence, ou MTS) et l’optogénétique, visant à préserver ou restaurer la vision chez les patients atteints de maladies neurodégénératives de la rétine. Le candidat médicament le plus avancé de GenSight Biologics, GS010, est en Phase III pour le traitement de la neuropathie optique héréditaire de Leber (NOHL), une maladie mitochondriale rare qui conduit à une perte irréversible de la vue chez les adolescents et les jeunes adultes. En utilisant son approche de thérapie génique, les candidats médicaments de GenSight Biologics sont destinés à offrir aux patients une récupération visuelle fonctionnelle durable après une seule injection intra-vitréenne dans chaque œil.
À propos de GS010
GS010 cible la neuropathie optique héréditaire de Leber (NOHL), et s’appuie sur une technologie propriétaire de séquence de ciblage mitochondrial (MTS), issue des travaux de l’Institut de la Vision, qui, lorsqu’elle est associée au gène d’intérêt, permet de l’adresser spécifiquement à l’intérieur de la mitochondrie grâce à un vecteur AAV (Adeno- Associated Virus). Le gène d’intérêt est ainsi transféré dans la cellule pour y être exprimé et produire la protéine fonctionnelle, qui sera acheminée à l’intérieur des mitochondries grâce aux séquences nucléotidiques spécifiques, afin de restaurer la fonction mitochondriale déficiente ou manquante.
À propos de la Neuropathie Optique Héréditaire de Leber (NOHL)
La neuropathie optique héréditaire de Leber (NOHL) est une maladie mitochondriale rare, de transmission maternelle, caractérisée par une dégénérescence des cellules ganglionnaires de la rétine et provoquant en moins d’un an une perte brutale et irréversible de la vision conduisant généralement à la cécité légale. Ces symptômes apparaissent principalement chez les adolescents et les jeunes adultes. La NOHL provoque une perte brutale, soudaine et sans douleur de la vision centrale dans le 1er œil, puis le 2nd œil est atteint à son tour, de manière irréversible. 97% des patients présentent une perte bilatérale de la vision en moins d’un an, et cette perte de vision est simultanée dans 25% des cas. La NOHL causerait la cécité visuelle chez environ 1 400 à 1 500 personnes par an aux Etats-Unis et en Europe.
À propos de RESCUE et REVERSE
RESCUE et REVERSE sont deux études distinctes pivotales de Phase III randomisées, en double masqué, contrôlées par injection simulée (sham), conçues pour évaluer l’efficacité d’une injection intravitréenne unique de GS010 (rAAV2/2-ND4) chez des sujets atteints de la NOHL induite par la mutation G11778A ND4.
Le critère d’évaluation principal mesurera la différence d’efficacité de GS010 entre les yeux traités et les yeux non- traités (sham), sur la base de l’acuité visuelle (Best Corrected Visual Acuity ou BCVA), mesurée à l’aide de l’échelle ETDRS à 48 semaines après injection. Les scores « Logarithm of the Minimal Angle of Resolution » des patients, ou LogMAR, qui sont dérivés du nombre de lettres lues sur l’échelle ETDRS, seront utilisés à des fins statistiques. Les deux études ont été conçues pour évaluer une différence statistiquement significative d’au moins 15 lettres ETDRS entre les yeux traités et non-traités (sham), ajustés de l’acuité visuelle initiale (baseline).
Les critères d’évaluation secondaires incluront l’application de l’analyse principale aux yeux ayant reçu GS010 et présentant à l’inclusion la meilleure acuité visuelle initiale (« meilleur œil »), comparés à ceux ayant reçu la procédure sham, ainsi qu’aux yeux ayant reçu GS010 et présentant la moins bonne acuité visuelle initiale (« moins bon œil »), comparés à ceux ayant reçu la procédure sham. Egalement, une évaluation de la proportion de patients « répondeurs » sera réalisée, incluant notamment le pourcentage de patients qui maintiennent leur acuité visuelle (perte de moins de 15 lettres ETDRS), le pourcentage de patients qui améliorent leur acuité visuelle de 15 lettres ETDRS ou plus, ainsi que le pourcentage de patients présentant une acuité visuelle finale >20/200, ou 1/10. Les paramètres visuels mesurés incluront également les champs visuels automatisés, la tomographie par cohérence optique, ainsi que la sensibilité aux couleurs et aux contrastes, en plus des mesures de qualité de vie, de bio- dissémination, et de réponse immunitaire post-injection.
Les études sont actuellement menées en parallèle, chez 37 patients pour REVERSE et 39 patients pour RESCUE, dans 7 centres aux Etats-Unis, au Royaume-Uni, en France, en Allemagne et en Italie. Les premiers résultats à 48 semaines de suivi sont attendus au 2ème trimestre 2018 pour REVERSE, et au 3ème trimestre 2018 pour RESCUE.
Identifiants ClinicalTrials.gov :
REVERSE: NCT02652780
RESCUE: NCT02652767
–
1 Avant injection (baseline), l’œil traité le plus affecté présentait une acuité visuelle médiane de 2,79 LogMAR (approximativement équivalent à percevoir un mouvement de la main à 1m) et l’œil non-traité le moins affecté présentait une acuité visuelle médiane de 2,01 LogMAR (approximativement équivalent à compter des doigts à 50cm).
2 2,79 LogMAR est approximativement équivalent à percevoir un mouvement de la main à 1m (« hand motion »). Le protocole de Phase III exclut les patients dits « hand motion ».
3 Un gain d’acuité visuelle cliniquement significatif est défini par une évolution, par rapport à la baseline, d’au moins -0,3 LogMAR (correspondant à un gain ≥ 15 lettres ETDRS).
4 La perte de vision remontait pour l’un des patients à 9 mois (correspondant à la fourchette de 6 à 12 mois définie pour l’étude REVERSE) et pour quatre autres patients à entre 1 et 2 ans. Aucun patient n’aurait été éligible à l’étude RESCUE (perte de vision < 6 mois).
Contacts
-
GenSight BiologicsDirecteur Administratif et FinancierThomas Gidoin+33 (0)1 76 21 72 20