- L’acuité visuelle moyenne (BCVA) dans les yeux traités et sham a évolué selon des trajectoires similaires, se dégradant jusqu’à un point bas, ou nadir, avant de commencer à s’améliorer jusqu’à la semaine 48 – cohérent avec REVERSE
- L’analyse statistique suggère qu’à 48 semaines, les yeux traités avaient 3 fois plus de chances que les yeux sham de présenter une acuité visuelle de 20/200 ou plus, le seuil légal de cécité
- 1 patient sur 4 présente une meilleure progression de l’acuité visuelle depuis la baseline dans l’œil traité comparé à l’œil sham (au moins 0,3 LogMAR ou 15 lettres ETDRS, une différence cliniquement significative)
- 1 patient sur 4 présente une meilleure progression de la sensibilité aux contrastes depuis la baseline dans l’œil traité comparé à l’œil sham (au moins 0,3 LogCS, une différence cliniquement significative)
- Les mesures anatomiques montrent des résultats globalement cohérents avec l’évolution de l’acuité visuelle
- GS010 est rapporté comme étant sûr et bien toléré
Paris, France, le 4 février 2019, 7h30 CET – GenSight Biologics (Euronext : SIGHT, ISIN : FR0013183985, éligible PEA-PME), société biopharmaceutique dédiée à la découverte et au développement de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central, annonce aujourd’hui les premiers résultats à 48 semaines de l’étude clinique de Phase III RESCUE, qui évalue la sécurité et l’efficacité d’une seule injection intra-vitréenne de GS010 (rAAV2/2-ND4) chez 39 patients atteints de neuropathie optique héréditaire de Leber (NOHL) induite par la mutation 11778-ND4, et chez qui la perte d’acuité visuelle a débuté moins de 6 mois avant le traitement. Les patients ont reçu GS010 dans un œil et une procédure sham dans l’autre œil (injection simulée). Le traitement était randomisé entre l’œil le moins atteint (« meilleur œil ») et le plus atteint (« moins bon œil »).
La perte de vision dans la LHON progresse rapidement jusqu’à atteindre un point bas, ou nadir, en 3 à 5 mois avant de se stabiliser. La durée de cette descente vers le nadir varie d’un patient à l’autre. Dans RESCUE, l’acuité visuelle moyenne (best-corrected visual acuity ou BCVA) des yeux traités et sham a évolué selon des trajectoires similaires, se dégradant jusqu’à un point bas, avant de commencer à s’améliorer jusqu’à la semaine 48. A 48 semaines, la variation moyenne d’acuité visuelle, comparée à la baseline, était de -19 lettres ETDRS dans les yeux traités par GS010, et de -20 lettres ETDRS dans les yeux sham. Cette variation intègre une récupération à partir du nadir de perte de vision dans les yeux traités et sham : l’amélioration moyenne passé le nadir était de +13 lettres ETDRS dans les yeux traités par GS010, et de +11 lettres ETDRS dans les yeux sham. Le critère d’évaluation principal, défini comme une différence d’amélioration de l’acuité visuelle de 15 lettres entre les yeux traités par GS010 et les yeux sham après 48 semaines de suivi, n’a pas été atteint.
Figure 1. Illustration de la progression de l’acuité visuelle dans RESCUE
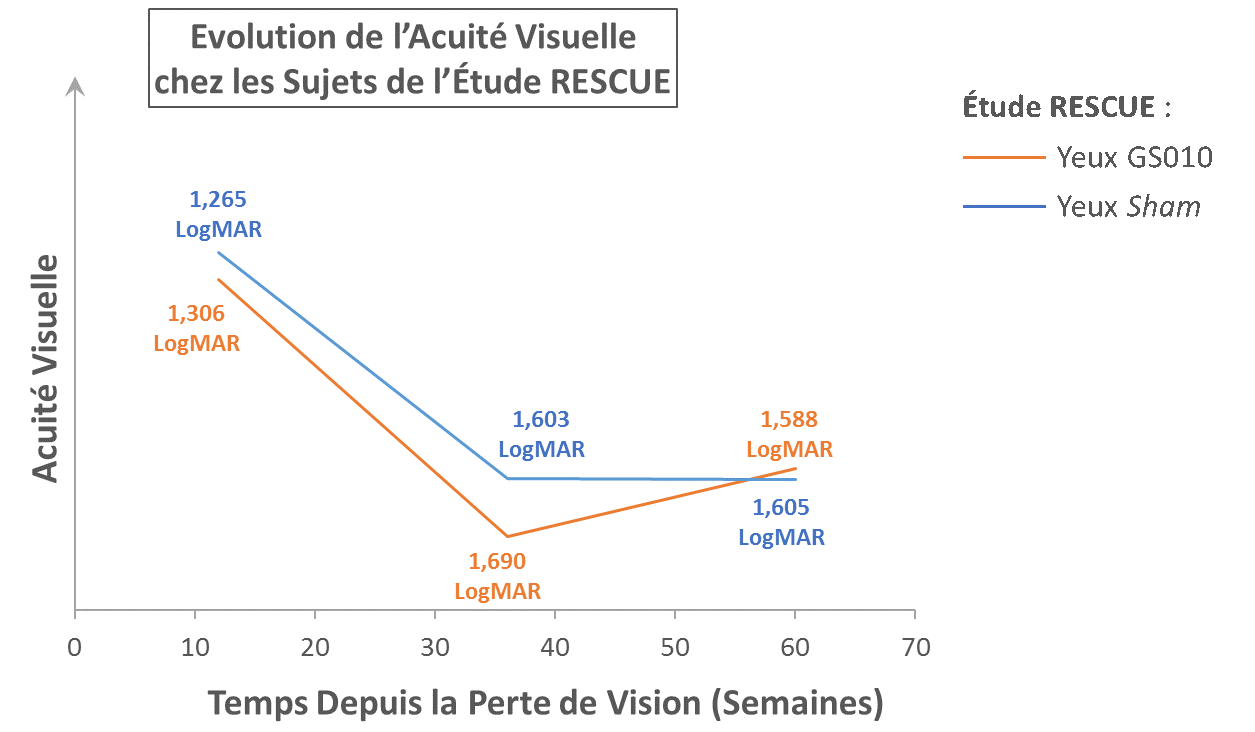
Note: Ce graphique est uniquement à titre d’illustration. Les valeurs observées d’acuité visuelle (LogMAR) ont été utilisées pour calculer les moyennes d’acuité visuelle, aucune donnée n’a été imputée. L’échelle de LogMAR a été inversée pour représenter l’amélioration d’acuité visuelle vers le haut. Une pente positive représente une amélioration ; une pente négative représente une perte de vision. Puisque la durée de perte de vision au départ de l’étude RESCUE pouvait varier de 0 à 6 mois avant traitement, l’acuité visuelle de départ est représentée à une durée moyenne de 3 mois après le début de la perte de vision (12 semaines).
L’analyse programmée des autres fonctions visuelles et des mesures anatomiques a montré des résultats globalement cohérents avec l’évolution de l’acuité visuelle : trajectoires similaires des yeux traités et sham, avec une différence de variation par rapport à la baseline non statistiquement significative à 48 semaines. L’évolution par rapport à la baseline de l’épaisseur du quadrant temporal de la couche des fibres nerveuses rétiniennes était en faveur des yeux traités par GS010 comparée aux yeux sham, manquant la significativité (p=0,0513). L’évolution par rapport à la baseline de l’épaisseur du faisceau papillomaculaire et du volume de cellules ganglionnaires était supérieure dans les yeux traités par GS010 comparé aux yeux sham, sans être statistiquement significative (valeurs p > 0,05).
Malgré une lecture précoce à 48 semaines, des tendances vont dans le sens de l’efficacité de GS010. Les yeux traités par GS010 avaient significativement plus de chances que les yeux sham de présenter une vision de 20/200 ou plus, seuil légal de cécité (statistiquement significatif, p=0,0347 ; odds ratio = 2,9). Une analyse du taux de réponse a montré que 24% des patients présentaient une différence d’acuité visuelle cliniquement significative (≥ 0,3 LogMAR ou 15 lettres ETDRS), par rapport à la baseline, dans les yeux traités comparé aux yeux sham. Une autre analyse a montré que 24% des patients présentaient une différence de sensibilité aux contrastes (mesurée sur l’échelle de Pelli-Robson) cliniquement significative d’au moins 0,3 LogCS, par rapport à la baseline, dans les yeux traités comparé aux yeux sham.
« La puissante et rapide dégénérescence de neurones au début de la pathologie, combinée au temps nécessaire à GS010 pour permettre l’expression des protéines fonctionnelles, pourrait parasiter les mesures d’efficacité dans la phase précoce de progression de la maladie, » a commenté le Dr. José-Alain Sahel, Directeur de l’Institut de la Vision (Sorbonne-Université/Inserm/CNRS), Paris; Chef du service d’Ophtalmologie, Centre Hospitalier National d’Ophtalmologie des XV-XX, Paris; Professeur et Chef du service d’Ophtalmologie, University of Pittsburgh School of Medicine et UPMC (University of Pittsburgh Medical Center); et co-fondateur de GenSight Biologics.
Le Dr. Barrett Katz, Directeur Médical de GenSight Biologics, a ajouté « Dans notre étude REVERSE, qui incluait des patients avec une perte de vision entre 6 et 12 mois avant traitement, nous avons pu observer des améliorations plus importantes des mesures anatomiques et des fonctions visuelles, alors que la maladie entrait dans sa phase chronique. Les résultats programmés à 72 et 96 semaines de RESCUE devraient confirmer l’efficacité de GS010. »
Figure 2. Illustration de la cohérence entre RESCUE et REVERSE
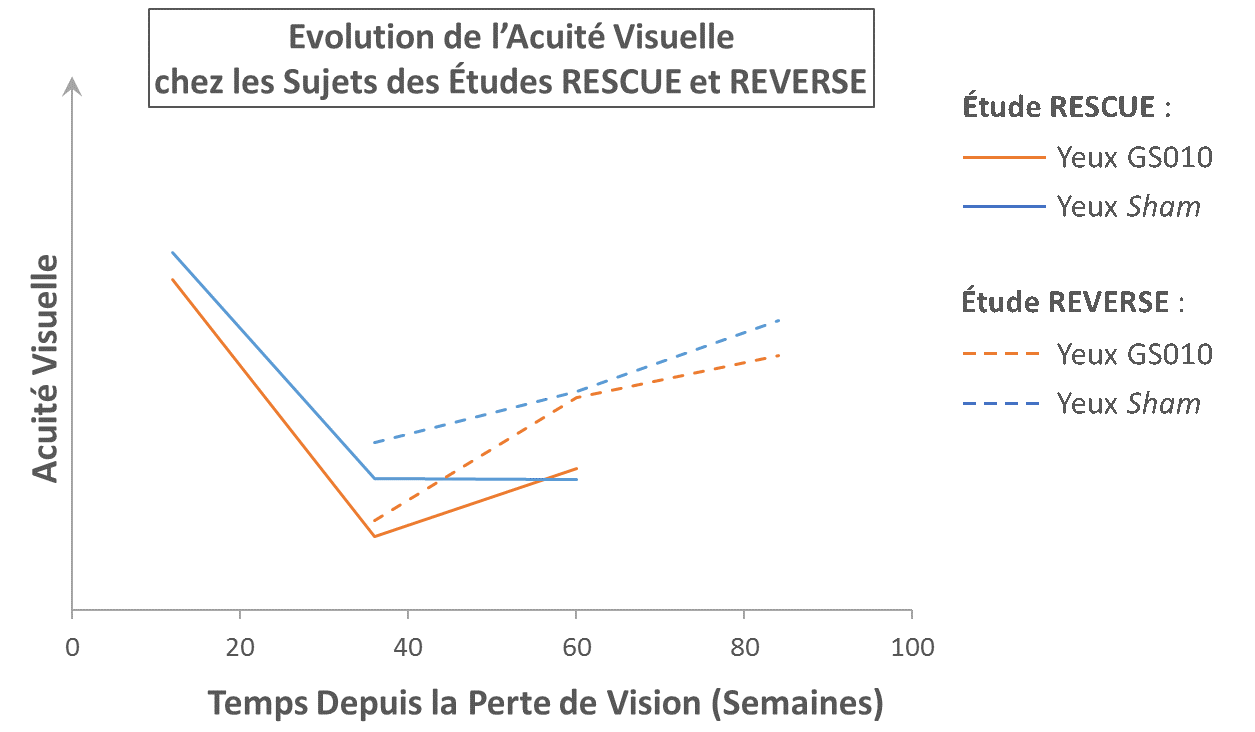
Note: Ce graphique est uniquement à titre d’illustration. Les valeurs observées d’acuité visuelle (LogMAR) ont été utilisées pour calculer les moyennes d’acuité visuelle, aucune donnée n’a été imputée. L’échelle de LogMAR a été inversée pour représenter l’amélioration d’acuité visuelle vers le haut. Une pente positive représente une amélioration ; une pente négative représente une perte de vision. Puisque la durée de perte de vision au départ de l’étude RESCUE pouvait varier de 0 à 6 mois avant traitement, l’acuité visuelle de départ est représentée à une durée moyenne de 3 mois après le début de la perte de vision (12 semaines). Puisque la durée de perte de vision au départ de l’étude REVERSE pouvait varier de 6 à 12 mois avant traitement, l’acuité visuelle de départ est représentée à une durée moyenne de 9 mois après le début de la perte de vision (36 semaines).
« Comme anticipé, les résultats à 48 semaines de RESCUE présentent un tableau plus complexe, en raison de l’intense, brutale et extrêmement rapide dégénérescence des cellules ganglionnaires, » a déclaré Bernard Gilly, Co-fondateur et Directeur Général de GenSight Biologics. « Mais comme observé dans REVERSE, des résultats plus tardifs devraient confirmer notre confiance dans l’efficacité de GS010. Nous attendons avec impatience ces prochains résultats, alors que nous nous préparons à discuter avec les autorités réglementaires. Nous restons engagés à mettre GS010 sur le marché dans les meilleurs délais, afin d’apporter aux patients un traitement efficace contre cette terrible maladie cécitante. »
L’analyse préliminaire des données de sécurité a montré que GS010 a été bien toléré pendant 48 semaines. Il n’y a eu aucun événement indésirable oculaire sérieux, ni aucune sortie d’étude en raison de problèmes oculaires. Les événements indésirables oculaires les plus fréquemment rapportés étaient liés à la procédure d’injection. Une élévation transitoire de la pression intraoculaire a parfois été observée, et attribuée à l’inflammation intraoculaire probablement liée à l’administration de GS010. Ces épisodes ont répondu au traitement standard, sans laisser de séquelles. Il n’y a eu aucun événement indésirable systémique sérieux, et aucune sortie d’étude en raison du traitement ou de la procédure.
Les sujets de RESCUE seront à nouveau évalués à 72 et 96 semaines, et ces résultats sont attendus respectivement au 2ème (avril) et au 3ème trimestres 2019. Les résultats à 96 semaines de l’étude REVERSE sont attendus au 2ème trimestre (mai) 2019. Les données seront alors « démasquées » durant cette évaluation, permettant l’analyse individuelle de chaque patient.
La troisième étude interventionnelle de GS010, REFLECT, est un essai de phase III randomisé, en double masqué et contrôlé par placebo, qui vise à évaluer la sécurité et l’efficacité d’injections bilatérales de GS010 chez les patients ayant perdu la vue depuis moins d’un an des suites de la NOHL. Le premier patient de REFLECT a été traité en mars 2018.
La Société tiendra une conférence téléphonique aujourd’hui, 4 février 2019, à 10h00 CET en français, et à 14h30 CET (8h30 ET) en anglais, afin de discuter ces résultats préliminaires.
Webcast & Conférence téléphonique en français
Numéros de la conférence téléphonique (appel local) :
- France : +33 170710159 PIN : 15229510#
- Royaume-Uni : +44 2071943759 PIN : 15229510#
- Lien Webcast : https://channel.royalcast.com/webcast/gensightbiologicsfr/20190204_1/
Webcast & Conférence téléphonique en anglais
Numéros de la conférence téléphonique (appel local) :
- France : +33 172727403 PIN : 53959568#
- Royaume-Uni : +44 2071943759 PIN : 53959568#
- Etats-Unis : +1 6467224916 PIN : 53959568#
- Lien Webcast : https://channel.royalcast.com/webcast/gensightbiologicsen/20190204_1/
Une rediffusion de la conférence téléphonique et du webcast sera disponible en utilisant les liens ci-dessus.
À propos de GenSight Biologics
GenSight Biologics S.A. (GenSight Biologics) est une société biopharmaceutique dédiée à la découverte et au développement de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central. Le portefeuille de recherche de GenSight Biologics s’appuie sur deux plates-formes technologiques : le ciblage mitochondrial (Mitochondrial Targeting Sequence, ou MTS) et l’optogénétique, visant à préserver ou restaurer la vision chez les patients atteints de maladies neurodégénératives de la rétine. Le candidat médicament le plus avancé de GenSight Biologics, GS010, est en Phase III pour le traitement de la neuropathie optique héréditaire de Leber (NOHL), une maladie mitochondriale rare qui conduit à une perte irréversible de la vue chez les adolescents et les jeunes adultes. En utilisant son approche de thérapie génique, les candidats médicaments de GenSight Biologics sont destinés à offrir aux patients une récupération visuelle fonctionnelle durable après une seule injection intra-vitréenne dans chaque œil.
À propos de GS010
GS010 cible la neuropathie optique héréditaire de Leber (NOHL), et s’appuie sur une technologie propriétaire de séquence de ciblage mitochondrial (MTS), issue des travaux de l’Institut de la Vision, qui, lorsqu’elle est associée au gène d’intérêt, permet de l’adresser spécifiquement à l’intérieur de la mitochondrie grâce à un vecteur AAV (Adeno-Associated Virus). Le gène d’intérêt est ainsi transféré dans la cellule pour y être exprimé et produire la protéine fonctionnelle, qui sera acheminée à l’intérieur des mitochondries grâce aux séquences nucléotidiques spécifiques, afin de restaurer la fonction mitochondriale déficiente ou manquante.
À propos de RESCUE et REVERSE
RESCUE et REVERSE sont deux études distinctes de Phase III randomisées, en double masqué, contrôlées par injection simulée (sham), conçues pour évaluer l’efficacité d’une injection intravitréenne unique de GS010 (rAAV2/2-ND4) chez des sujets atteints de la NOHL induite par la mutation G11778A ND4.
Le critère d’évaluation principal mesurera la différence d’efficacité de GS010 entre les yeux traités et les yeux non-traités (sham), sur la base de l’acuité visuelle (Best Corrected Visual Acuity ou BCVA), mesurée à l’aide de l’échelle ETDRS à 48 semaines après injection. Les scores « Logarithm of the Minimal Angle of Resolution » des patients, ou LogMAR, qui sont dérivés du nombre de lettres lues sur l’échelle ETDRS, seront utilisés à des fins statistiques. Les deux études ont été conçues pour évaluer une différence statistiquement significative d’au moins 15 lettres ETDRS entre les yeux traités et non-traités (sham), ajustés de l’acuité visuelle initiale (baseline).
Les critères d’évaluation secondaires incluront l’application de l’analyse principale aux yeux ayant reçu GS010 et présentant à l’inclusion la meilleure acuité visuelle initiale (« meilleur œil »), comparés à ceux ayant reçu la procédure sham, ainsi qu’aux yeux ayant reçu GS010 et présentant la moins bonne acuité visuelle initiale (« moins bon œil »), comparés à ceux ayant reçu la procédure sham. Egalement, une évaluation de la proportion de patients « répondeurs » sera réalisée, incluant notamment le pourcentage de patients qui maintiennent leur acuité visuelle (perte de moins de 15 lettres ETDRS), le pourcentage de patients qui améliorent leur acuité visuelle de 15 lettres ETDRS ou plus, ainsi que le pourcentage de patients présentant une acuité visuelle finale >20/200, ou 1/10. Les paramètres visuels mesurés incluront également les champs visuels automatisés, la tomographie par cohérence optique, ainsi que la sensibilité aux couleurs et aux contrastes, en plus des mesures de qualité de vie, de bio-dissémination, et de réponse immunitaire post-injection.
Les études sont actuellement menées en parallèle, chez 37 patients pour REVERSE et 39 patients pour RESCUE, dans 7 centres aux Etats-Unis, au Royaume-Uni, en France, en Allemagne et en Italie. Les premiers résultats à 48 semaines de suivi de RESCUE sont attendus au début du 1er trimestre 2019.
Identifiants ClinicalTrials.gov :
REVERSE: NCT02652780
RESCUE: NCT02652767
Contacts
-
Orpheon FinanceInvestisseurs ParticuliersJames Palmer+33 7 60 92 77 74