- Différence cliniquement significative entre les résultats visuels des patients traités par LUMEVOQ® et ceux des patients non traités
Paris, France, le 1er juin 2021, 7h30 CEST – GenSight Biologics (Euronext: SIGHT, ISIN: FR0013183985, éligible PEA-PME), société biopharmaceutique dédiée au développement et à la commercialisation de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux centrale, annonce aujourd’hui la publication dans la revue Frontiers in Neurology des résultats de la comparaison indirecte de l’évolution visuelle chez les patients traités par la thérapie génique LUMEVOQ® avec l’évolution spontanée rapportée dans les études d’histoire naturelle (HN) de patients atteints de Neuropathie Optique Héréditaire de Leber (NOHL) porteurs de la mutation m.11778G>A ND4 (patients MT-ND4).
L’article*, publié dans le numéro de mai sous le titre “Intravitreal Gene Therapy vs. Natural History in Patients with Leber Hereditary Optic Neuropathy Carrying the m.11778G>A ND4 Mutation : Systematic Review and Indirect Comparison”, a révélé une différence d’acuité visuelle statistiquement et cliniquement significative en faveur des patients traités par LUMEVOQ® comparés aux patients non traités. L’évolution de l’acuité visuelle (best-corrected visual acuity ou BCVA) des patients traités par LUMEVOQ® a montré une amélioration progressive et durable entre les Mois 12 et Mois 52 après le début de perte de vision, tandis que les patients non traités ont vu leur acuité visuelle se détériorer au cours de la même période.
Figure 1. Évolution de l’acuité visuelle chez les patients traités par LUMEVOQ® versus celle observée chez les patients non traités
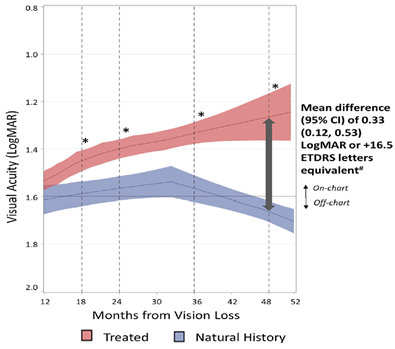
Remarque : Tous les patients étaient porteurs d’une mutation G11778A confirmée dans le gène mitochondrial ND4 et étaient âgés de 15 ans minimum. Le graphique montre les courbes obtenues par la méthode Locally Estimated Scatterplot Smoothing (LOESS) modélisant l’acuité visuelle des patients traités par LUMEVOQ® et des patients non traités. Les zones colorées représentent l’intervalle de confiance à 95% de l’acuité visuelle (BCVA) moyenne. Les données concernant les yeux ‘traités’ proviennent de tous les yeux (LUMEVOQ® et injection simulée sham) des études RESCUE, REVERSE et CLIN06 (N=76 patients / 152 yeux). Les données concernant les yeux ‘non traités’ proviennent des données des patients de l’étude REALITY et d’une série appariée de données issues de deux études prospectives et huit études rétrospectives sur l’histoire naturelle de la maladie1 (N=208 patients / 408 yeux). *La différence statistiquement significative entre l’acuité visuelle moyenne des yeux traités et des yeux non traités est illustrée par le non-chevauchement des intervalles de confiance des courbes LOESS.
« L’analyse détaillée de ce que la littérature scientifique rapporte de l’histoire naturelle de cette terrible maladie cécitante confirme bien son faible prognostique visuel, » déclare le Dr Nancy J. Newman, premier auteur de l’article, investigateur principal de l’essai RESCUE, et Professeur d’Ophtalmologie et de Neurologie LeoDelle Jolley, à Emory University School of Medicine, Atlanta, Géorgie, Etats-Unis.
La publication dans la revue scientifique à comité de lecture représente une validation des analyses soumises dans le dossier de demande d’autorisation de mise sur le marché de LUMEVOQ® en Europe, déposé en septembre 2020. L’examen du dossier est en cours, et la décision de l’EMA est attendue au S1 2022.
Aperçu de la méthodologie de la comparaison indirecte
L’approche de la comparaison indirecte a été mise en place parce qu’un effet controlatéral inattendu et significatif dans les essais de phase III RESCUEa et REVERSEb a effectivement invalidé les yeux sham en tant que groupe témoin pour les yeux injectés avec le médicament. Pour mieux caractériser l’efficacité de LUMEVOQ®, il a fallu constituer un groupe de patients sans traitement, représentatif de l’histoire naturelle, et présentant la même mutation que les patients des essais cliniques.
Les auteurs ont constitué un groupe dit « d’efficacité » en combinant toutes les observations de l’acuité visuelle des 76 patients des études pivotales RESCUE et REVERSE, de l’inclusion à la Semaine 96, avec celles des patients ayant accepté de participer à l’étude de suivi à long terme RESTORE (CLIN06). En raison de l’effet controlatéral démontré dans ces études, les mesures de l’acuité visuelle des yeux traités par une injection simulée (sham) ont été incluses dans l’ensemble de données du groupe traité.
L’ensemble des données sur l’histoire naturelle a été recueillie chez les patients qui n’ont pas été traités par LUMEVOQ® ; bien qu’ils aient toutefois pu être traités par l’idébénone. Les données du groupe contrôle externe provenaient du registre d’histoire naturelle REALITYc, et des données des patients décrites dans 10 articles publiés sur la NOHL-ND4, identifiés par une analyse systématique de la littératured. Seules les études présentant des valeurs d’acuité visuelle individuelles et précisant le temps écoulé après le début de perte de vision dans des cohortes comprenant au moins cinq patients MT-ND4 ont été considérées (208 patients).
Le Mois (M)12 après le début de la perte de vision a été défini comme le point de départ de la comparaison indirecte, dans la mesure où 93% des patients LUMEVOQ® avaient été traités à cette date. L’évolution de l’acuité visuelle a été estimée à l’aide d’un modèle de régression locale non paramétrique utilisant des courbes de lissage de nuage de points estimées localement (Locally Estimated Scatterplot Smoothing, LOESS).
Principales conclusions de la comparaison indirecte
Les yeux traités avaient une meilleure acuité visuelle que les yeux de l’histoire naturelle à M12, M18, M24, M36 et M48 après le début de perte de vision. La différence d’acuité visuelle moyenne était statistiquement significative à tous ces intervalles de temps, avec une différence cliniquement significative à 48 mois s’élevant à +16,5 lettres ETDRS (un gain de plus de 3 lignes sur l’échelle ETDRS), en faveur des yeux traités. L’effet du traitement a été confirmé même après la prise en compte dans une analyse multivariée de covariables confondantes telles que l’âge au début de la perte de vision, le sexe, et la durée du suivi.
L’effet du traitement s’est reflété de la même manière dans le taux d’yeux “répondeurs”, qui était environ deux fois plus élevé lorsque les patients étaient traités, quelle que soit le critère de réponse choisi (pourcentage d’yeux ayant une acuité visuelle ‘on-chart’ à M48 et à la dernière observation ; ou pourcentage d’yeux au-dessus des critères de cécité de l’OMS à M48 et à la dernière observation).
Cette publication est disponible à l’adresse suivante :
https://www.frontiersin.org/articles/10.3389/fneur.2021.662838/full.
* À propos de la publication :
Intravitreal Gene Therapy vs. Natural History in Patients with Leber Hereditary Optic Neuropathy Carrying the m.11778G>A ND4 Mutation: Systematic Review and Indirect Comparison
(Thérapie génique intravitréenne comparée à l’histoire naturelle chez les patients atteints de Neuropathie Optique Héréditaire de Leber porteurs de la mutation m.11778G>A ND4: analyse systématique et comparaison indirecte)
Auteurs : Nancy J. Newman1, Patrick Yu-Wai-Man,2,3,4,5, Valerio Carelli6,7, Valerie Biousse1, Mark L. Moster8, Catherine Vignal-Clermont9,10, Robert C. Sergott8, Thomas Klopstock11,12,13, Alfredo A. Sadun14, Jean François Girmens10, Chiara La Morgia6, Adam A. DeBusk8, Neringa Jurkute4,5, Claudia Priglinger15, Rustum Karanjia14,16, Constant Josse17, Julie Saltzmann18, François Montestruc17, Michel Roux19, Magali Taiel19, and José-Alain Sahel 20,21,22,23 for the LHON Study Group
Affiliations:
1 Departments of Ophthalmology, Neurology and Neurological Surgery, Emory University School of Medicine, Atlanta, GA, United States
2 Cambridge Centre for Brain Repair and MRC Mitochondrial Biology Unit, Department of Clinical Neurosciences, University of Cambridge, Cambridge, United Kingdom
3 Cambridge Eye Unit, Addenbrooke’s Hospital, Cambridge University Hospitals, Cambridge, United Kingdom
4 Moorfields Eye Hospital National Health Service Foundation Trust, London, United Kingdom
5 UCL Institute of Ophthalmology, University College London, London, United Kingdom
6 Istituto di Recovero e Cura a Carattere Scientifico Istituto delle Scienze Neurologiche di Bologna, Unità Operativa Compless Clinica Neurologica, Bologna, Italy
7 Unit of Neurology, Department of Biomedical and Neuromotor Sciences, University of Bologna, Bologna, Italy
8 Departments of Neurology and Ophthalmology, Wills Eye Hospital and Thomas Jefferson University, Philadelphia, PA, United States
9 Department of Neuro Ophthalmology and Emergencies, A. de Rothschild Foundation Hospital, Paris, France
10 Centre d’investigation Clinique, Centre Hospitalier National d’Ophtalmologie des Quinze Vingts, Paris, France
11 Department of Neurology, Friedrich-Baur-Institute, University Hospital, Ludwig-Maximilians-University Munich, Munich, Germany
12 German Center for Neurodegenerative Diseases, Munich, Germany
13 Munich Cluster for Systems Neurology, Munich, Germany
14 Doheny Eye Institute, University of California School of Medicine, Los Angeles, CA, United States
15 Department of Ophthalmology, University Hospital, Ludwig-Maximilians-University Munich, Munich, Germany
16 Department of Ophthalmology, University of Ottawa Eye, Ottawa, ON, Canada
17 eXYSTAT, Data Management and Statistic, Malakoff, France
18 Medical and Regulatory Consulting, Paris, France
19 GenSight Biologics, Paris, France
20 Sorbonne Université, INSERM, CNRS, Institut de la Vision, Paris, France
21 A. de Rothschild Foundation Hospital, Paris, France
22 Department of Ophthalmology, The University of Pittsburgh School of Medicine, Pittsburgh, PA, United States
23 CHNO des Quinze-Vingts, Institut Hospitalo-Universitaire FOReSIGHT, INSERM-DGOS CIC 1423, Paris, France
Notes :
a Newman NJ, Yu-Wai-Man P, Carelli V, Moster ML, Biousse V, Vignal-Clermont C, et al. Efficacy and safety of intravitreal gene therapy for leber hereditary optic neuropathy treated within 6 months of disease onset. Ophthalmology. (2021) 128:649–60. doi: 10.1016/j.ophtha.2020.12.012.
b Yu-Wai-Man P, Newman NJ, Carelli V, Moster ML, Biousse V, Sadun AA, et al. Bilateral visual improvement with unilateral gene therapy injection for Leber hereditary optic neuropathy. Sci Transl Med. (2020) 12:eaaz7423. doi: 10.1126/scitranslmed.aaz7423
c Yu-Wai-Man P, Newman NJ, Carelli V, La Morgia C, Biousse V, Bandello FM, et al. Natural history of patients with Leber hereditary optic neuropathy—results from the REALITY study. Eye (2021). https://doi.org/10.1038/s41433-021-01535-9
d Newman NJ, Carelli V, Taiel M, Yu-Wai-Man P. Visual outcomes in Leber hereditary optic neuropathy patients with the m.11778G>A (MTND4) mitochondrial dna mutation. J Neuroophthalmol. (2020) 40:547–57. doi: 10.1097/WNO.0000000000001045.
À propos de GenSight Biologics
GenSight Biologics S.A. (GenSight Biologics) est une société biopharmaceutique dédiée au développement et à la commercialisation de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central. Le portefeuille de recherche de GenSight Biologics s’appuie sur deux plates-formes technologiques : le ciblage mitochondrial (Mitochondrial Targeting Sequence, ou MTS) et l’optogénétique, visant à préserver ou restaurer la vision chez les patients atteints de maladies neurodégénératives de la rétine. Le candidat médicament le plus avancé de GenSight Biologics, LUMEVOQ® (GS010 ; lenadogene nolparvovec), a fait l’objet d’un dépôt de demande d’AMM en Europe pour le traitement de la neuropathie optique héréditaire de Leber (NOHL), une maladie mitochondriale rare affectant principalement les adolescents et les jeunes adultes et conduisant à une perte irréversible de la vue. En utilisant son approche de thérapie génique, les candidats médicaments de GenSight Biologics sont destinés à offrir aux patients une récupération visuelle fonctionnelle durable après une seule injection intravitréenne dans chaque œil.
À propos de la Neuropathie Optique Héréditaire de Leber (NOHL)
La neuropathie optique héréditaire de Leber (NOHL) est une maladie mitochondriale rare, de transmission maternelle, caractérisée par une dégénérescence des cellules ganglionnaires de la rétine et provoquant en moins d’un an une perte brutale et irréversible de la vision conduisant généralement à la cécité légale. Ces symptômes apparaissent principalement chez les adolescents et les jeunes adultes. La NOHL provoque une perte brutale, soudaine et sans douleur de la vision centrale dans le 1er œil, puis le 2nd œil est atteint à son tour, de manière irréversible. 97% des patients présentent une perte bilatérale de la vision en moins d’un an, et cette perte de vision est simultanée dans 25% des cas. La NOHL causerait la cécité visuelle chez environ 800-1 200 personnes par an aux Etats-Unis et en Europe.
À propos de LUMEVOQ® (GS010 ; lenadogene nolparvovec)
LUMEVOQ® (GS010 ; lenadogene nolparvovec) cible la neuropathie optique héréditaire de Leber (NOHL), et s’appuie sur une technologie propriétaire de séquence de ciblage mitochondrial (MTS), issue des travaux de l’Institut de la Vision à Paris, qui, lorsqu’elle est associée au gène d’intérêt, permet de l’adresser spécifiquement à l’intérieur de la mitochondrie grâce à un vecteur AAV (Adeno-Associated Virus). Le gène d’intérêt est ainsi transféré dans la cellule pour y être exprimé et produire la protéine fonctionnelle, qui sera acheminée à l’intérieur des mitochondries grâce aux séquences nucléotidiques spécifiques, afin de restaurer la fonction mitochondriale déficiente ou manquante. « LUMEVOQ » a été autorisé comme nom commercial pour le GS010 (lenadogene nolparvovec) par l’Agence Européenne des Médicaments (EMA) en octobre 2018.
À propos de RESCUE et REVERSE
RESCUE et REVERSE sont deux études distinctes de Phase III randomisées, en double masqué, contrôlées par injection simulée (sham), conçues pour évaluer l’efficacité d’une injection intravitréenne unique de GS010 (rAAV2/2ND4) chez des sujets atteints de la NOHL induite par la mutation G11778A ND4.
Le critère d’évaluation principal mesure la différence d’efficacité de GS010 entre les yeux traités et les yeux non traités (sham), sur la base de l’acuité visuelle (Best Corrected Visual Acuity ou BCVA), mesurée à l’aide de l’échelle ETDRS à 48 semaines après injection. Les scores « Logarithm of the Minimal Angle of Resolution » des patients, ou LogMAR, qui sont dérivés du nombre de lettres lues sur l’échelle ETDRS, sont utilisés à des fins statistiques. Les deux études ont été conçues pour évaluer une différence statistiquement significative d’au moins 15 lettres ETDRS entre les yeux traités et non-traités (sham), ajustés de l’acuité visuelle initiale (baseline).
Les critères d’évaluation secondaires incluent l’application de l’analyse principale aux yeux ayant reçu GS010 et présentant à l’inclusion la meilleure acuité visuelle initiale (« meilleur œil »), comparés à ceux ayant reçu la procédure sham, ainsi qu’aux yeux ayant reçu GS010 et présentant la moins bonne acuité visuelle initiale (« moins bon œil »), comparés à ceux ayant reçu la procédure sham. Également, une évaluation de la proportion de patients « répondeurs » est réalisée, incluant notamment le pourcentage de patients qui maintiennent leur acuité visuelle (perte de moins de 15 lettres ETDRS), le pourcentage de patients qui améliorent leur acuité visuelle de 15 lettres ETDRS, ainsi que le pourcentage de patients présentant une acuité visuelle finale >20/200. Les paramètres visuels mesurés incluent également les champs visuels automatisés, la tomographie par cohérence optique, ainsi que la sensibilité aux couleurs et aux contrastes, en plus des mesures de qualité de vie, de biodissémination, et de réponse immunitaire post-injection. Les lectures pour ces paramètres ont eu lieu à 48, 72 et 96 semaines après l’injection.
Les études ont été menées en parallèle, chez 37 patients pour REVERSE et 39 patients pour RESCUE, dans 7 centres aux États-Unis, au Royaume-Uni, en France, en Allemagne et en Italie. Les résultats à 96 semaines de suivi des deux études ont été publiés en 2019. Les patients ont ensuite été transférés vers une étude de suivi à long terme pour 3 années supplémentaires.
Identifiants ClinicalTrials.gov :
REVERSE : NCT02652780
RESCUE : NCT02652767
À propos de REALITY
REALITY est une étude observationnelle rétrospective et transversale internationale de sujets atteints de NOHL, basée sur les dossiers médicaux et l’administration d’enquêtes sur la qualité de vie liée à la santé (HRQoL), ainsi que les coûts directs et indirects associés à la maladie. L’étude a recruté 44 sujets (adultes et pédiatriques) principalement dans les pays suivants : Espagne, Italie, France, Royaume-Uni et États-Unis.
Les principaux objectifs de l’étude REALITY sont les suivants : décrire l’évolution des changements fonctionnels et structurels visuels, ainsi que d’autres symptômes associés chez les patients atteints de NOHL ; comprendre l’impact de la perte de vision liée à la NOHL sur la HRQoL ; et comprendre les impacts économiques pour les patients et leurs familles découlant des coûts directs et indirects associés à la maladie. L’objectif secondaire est de décrire la relation entre les facteurs génétiques, de style de vie et / ou environnementaux et l’expression du phénotype NOHL.
Le premier sujet a été recruté le 3 janvier 2018, et le recrutement a pris fin au début du second trimestre 2020.
Identifiants ClinicalTrials.gov :
REALITY LHON Registry: NCT03295071
Contacts
-
LifeSci AdvisorsRelations InvestisseursGuillaume van Renterghem+41 (0)76 735 01 31
-
Orpheon FinanceInvestisseurs ParticuliersJames Palmer+33 7 60 92 77 74