- Amélioration statistiquement significative de l’acuité visuelle des yeux traités par LUMEVOQ® par rapport à la baseline et au nadir
- Meilleure efficacité chez les patients traités bilatéralement
- Effet controlatéral confirmé, comme démontré dans les études REVERSE et RESCUE
- Bon profil de sécurité du traitement bilatéral
- Webcast avec des leaders d’opinions sur les résultats de REFLECT : 9 juillet à 14h CEST
Paris, France, le 30 juin 2021, 7h30 CEST – GenSight Biologics (Euronext: SIGHT, ISIN: FR0013183985, éligible PEA-PME), société biopharmaceutique dédiée au développement et à la commercialisation de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux centrale, annonce aujourd’hui les principaux résultats d’efficacité et de tolérance à 1,5 an (78 semaines) après traitement pour l’étude clinique de Phase III REFLECT de LUMEVOQ®. Les résultats montrent une meilleure amélioration de l’acuité visuelle des injections intravitréennes bilatérales de la thérapie génique par rapport à une injection unilatérale.
« Conformément aux directives rigoureuses encadrant les études cliniques pivotales, les données de REFLECT confirment que la thérapie génique LUMEVOQ a amélioré l’acuité visuelle, comme observé dans les études REVERSE et RESCUE, » déclare le Dr Robert Sergott, Chef du service de Neuro-Ophtalmologie, Wills Eye Hospital, et Fondateur et Directeur Général du William H. Annesley EyeBrain Center, Thomas Jefferson University, Philadelphie, Etats-Unis. « L’amélioration bilatérale surprenante et révolutionnaire observée avec une injection unilatérale a été retrouvée, et ce n’est certainement pas le fruit du hasard dans trois études indépendantes. »
Le Dr Sergott ajoute : « L’injection bilatérale de LUMEVOQ, montrant une meilleure efficacité sans compromis en termes de sécurité ou de tolérance, fait de la thérapie génique une excellente option thérapeutique. LUMEVOQ a changé la vie des patients atteints de neuropathie optique héréditaire de Leber. »
Conçue dans le cadre d’un SPA (Special Protocol Assessment) avec la FDA aux Etats-Unis, REFLECT est une étude de Phase III randomisée, double-masquée et contrôlée par placebo chez 98 sujets présentant une perte de vision due à la Neuropathie Optique Héréditaire de Leber (NOHL) causée par un gène mitochondrial ND4 muté ; les sujets ND4 inclus présentaient une perte de vision jusqu’à un an. La mutation mitochondriale ND4 est associée à la forme clinique la plus sévère de NOHL, avec une vision finale très faible.1 Tous les sujets ont reçu une injection intravitréenne (IVT) de LUMEVOQ® dans leur premier œil affecté. Le deuxième œil affecté a été randomisé pour recevoir soit une deuxième IVT de LUMEVOQ®, soit une IVT de placebo, administrée le même jour ou le suivant. 48 sujets ont été randomisés pour le traitement bilatéral de LUMEVOQ® et 50 pour le traitement unilatéral de LUMEVOQ® (premier œil affecté traité par LUMEVOQ®, deuxième œil affecté traité par placebo).
Amélioration significative de l’acuité visuelle par rapport à la baseline, avec de meilleurs résultats chez les patients ayant reçu une injection bilatérale
Au moment de l’évaluation du critère principal, 1,5 an après l’injection, l’acuité visuelle moyenne (BCVA) dans les yeux traités par LUMEVOQ® était meilleure que la baseline, de manière statistiquement significative, alors que l’amélioration par rapport à la baseline n’était pas statistiquement significative dans les yeux placebo.
Table 1 : Variation de l’acuité visuelle par rapport à la baseline, 1,5 an après l’injection
| 1er œil affecté | 2ème œil affecté | |
| Sujets injectés bilatéralement | LUMEVOQ
-0,23 LogMAR |
LUMEVOQ
-0,15 LogMAR |
| Sujets injectés unilatéralement | LUMEVOQ
-0,15 LogMAR |
PLACEBO
-0,08 LogMAR |
Comme observé dans les études REVERSE2 et RESCUE3, les sujets traités unilatéralement ont montré un effet controlatéral dans leur œil traité par placebo (Figure 1). L’effet controlatéral a réduit la différence entre les yeux traités par LUMEVOQ® et le placebo et, par conséquent, l’étude n’a pas atteint le critère principal d’évaluation prédéfini. La différence de variation d’acuité visuelle par rapport à la baseline entre les deuxièmes yeux affectés traités par LUMEVOQ® et traités par placebo était de -0,05 LogMAR (+ 3 lettres ETDRS ; p=0,6080).
Figure 1. Variation d’acuité visuelle (BCVA) par rapport à la baseline (LogMAR) – Groupes d’yeux
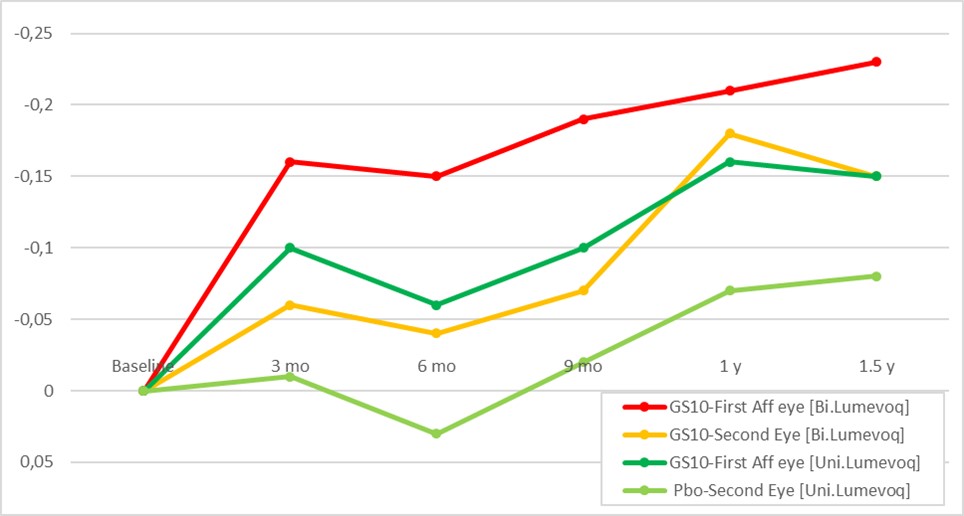
Remarque : Les moyennes (moindres carrés) des différences par rapport à la baseline en LogMAR sont estimées avec des modèles mixtes au niveau des yeux, ajustés sur la baseline, avec des valeurs répétées pour le patient.
Un effet dose, observé entre les sujets traités bilatéralement et unilatéralement, apporte de nouvelles preuves de l’efficacité de LUMEVOQ®. Dans chaque groupe, les acuités visuelles des deux yeux se sont améliorées par rapport à la baseline en tandem, mais avec un effet traitement plus élevé pour les sujets traités bilatéralement (Figure 2). L’acuité visuelle moyenne à 1,5 an pour les sujets traités bilatéralement et unilatéralement a atteint respectivement 1,35 et 1,45 LogMAR, avec une différence absolue entre les bras de +5 lettres en faveur des sujets traités bilatéralement.
Figure 2. Evolution de l’acuité visuelle dans le temps (LogMAR) – Groupes d’yeux
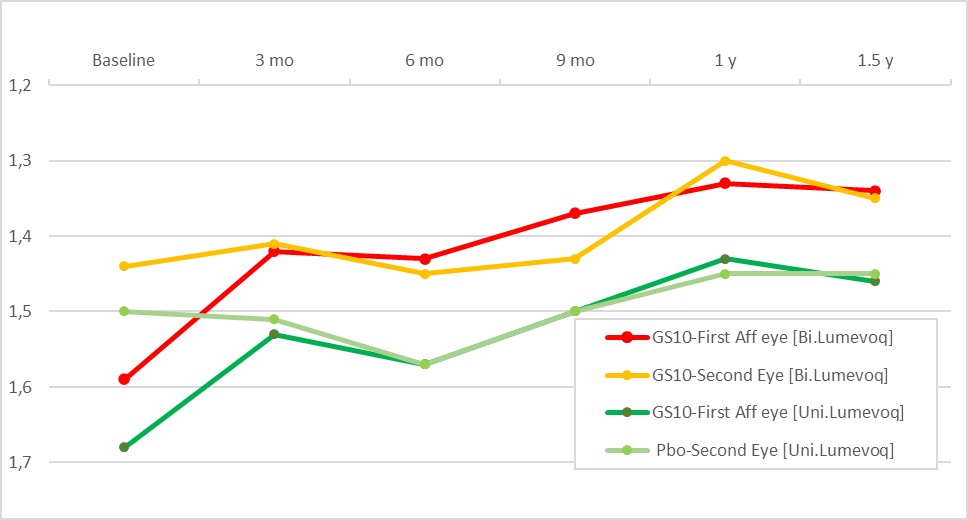
Remarque : LogMAR moyen à chaque mesure
Les analyses de répondeurs montrent que la plupart des sujets ont répondu au traitement et confirment que les injections bilatérales offrent une meilleure efficacité. La plupart des sujets avaient des acuités visuelles on-chart à 1,5 an (capables de lire des lettres sur un tableau) : 85 % des sujets traités bilatéralement et 72 % des sujets traités unilatéralement.
Efficacité démontrée encore plus clairement dans l’amélioration de l’acuité visuelle par rapport au nadir
La comparaison par rapport au nadir (la plus mauvaise acuité visuelle entre la baseline et 1,5 an) démontre encore plus clairement l’efficacité de LUMEVOQ®, y compris pour les yeux placebo qui ont présenté l’effet controlatéral.
Table 2: Variation d’acuité visuelle (BCVA) par rapport au nadir (LogMAR) – Groupes d’yeux
| 1er œil affecté | 2ème œil affecté | |
| Sujets injectés bilatéralement | LUMEVOQ
0,37 LogMAR |
LUMEVOQ
0,31 LogMAR |
| Sujets injectés unilatéralement | LUMEVOQ
0,37 LogMAR |
PLACEBO
0,25 LogMAR |
À 1,5 an, une amélioration d’au moins 3 lignes (15 lettres ETDRS) à partir du nadir a été démontrée chez 69% et 64% des sujets traités bilatéralement et unilatéralement, respectivement.
Profil de sécurité favorable des injections bilatérales
Le profil de sécurité favorable de LUMEVOQ® a été confirmé. Il n’y a eu aucune sortie d’étude liée à un événement indésirable systémique ou oculaire. Il n’y a eu aucun événement indésirable oculaire grave. Le principal événement indésirable oculaire était une inflammation intraoculaire, généralement légère, et répondant au traitement conventionnel. Le bon profil de sécurité était comparable chez les sujets traités unilatéralement et bilatéralement.
L’efficacité de LUMEVOQ® observée dans les trois études de Phase III – RESCUE, REVERSE et REFLECT – est très cohérente d’une étude à l’autre.
GenSight Biologics prévoit d’ajouter les résultats complets de REFLECT au dossier clinique de l’EMA dans le cadre de l’examen en cours de la demande d’autorisation de mise sur le marché de LUMEVOQ®, et présentera les analyses à la FDA plus tard cette année.
GenSight Biologics organisera un webcast avec des leaders d’opinion le vendredi 9 juillet 2021, à 14h00 CEST, pour présenter et discuter ces résultats. Les détails seront annoncés ultérieurement.
Références :
- Newman NJ, Carelli V, Taiel M, Yu-Wai-Man P. Visual outcomes in Leber hereditary optic neuropathy subjects with the m.11778G>A (MTND4) mitochondrial dna mutation. J Neuroophthalmol. (2020) 40:547–57. doi: 10.1097/WNO.0000000000001045.
- Yu-Wai-Man P, Newman NJ, Carelli V, Moster ML, Biousse V, Sadun AA, et al. Bilateral visual improvement with unilateral gene therapy injection for Leber hereditary optic neuropathy. Sci Transl Med. (2020) 12:eaaz7423. doi: 10.1126/scitranslmed.aaz7423
- Newman NJ, Yu-Wai-Man P, Carelli V, Moster ML, Biousse V, Vignal-Clermont C, et al. Efficacy and safety of intravitreal gene therapy for leber hereditary optic neuropathy treated within 6 months of disease onset. Ophthalmology. (2021) 128:649–60. doi: 10.1016/j.ophtha.2020.12.012.
À propos de GenSight Biologics
GenSight Biologics S.A. (GenSight Biologics) est une société biopharmaceutique dédiée au développement et à la commercialisation de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central. Le portefeuille de recherche de GenSight Biologics s’appuie sur deux plates-formes technologiques : le ciblage mitochondrial (Mitochondrial Targeting Sequence, ou MTS) et l’optogénétique, visant à préserver ou restaurer la vision chez les patients atteints de maladies neurodégénératives de la rétine. Le candidat médicament le plus avancé de GenSight Biologics, LUMEVOQ® (GS010 ; lenadogene nolparvovec), a fait l’objet d’un dépôt de demande d’AMM en Europe pour le traitement de la neuropathie optique héréditaire de Leber (NOHL), une maladie mitochondriale rare affectant principalement les adolescents et les jeunes adultes et conduisant à une perte irréversible de la vue. En utilisant son approche de thérapie génique, les candidats médicaments de GenSight Biologics sont destinés à offrir aux patients une récupération visuelle fonctionnelle durable après une seule injection intravitréenne dans chaque œil.
À propos de la Neuropathie Optique Héréditaire de Leber (NOHL)
La neuropathie optique héréditaire de Leber (NOHL) est une maladie mitochondriale rare, de transmission maternelle, caractérisée par une dégénérescence des cellules ganglionnaires de la rétine et provoquant en moins d’un an une perte brutale et irréversible de la vision conduisant généralement à la cécité légale. Ces symptômes apparaissent principalement chez les adolescents et les jeunes adultes. La NOHL provoque une perte brutale, soudaine et sans douleur de la vision centrale dans le 1er œil, puis le 2nd œil est atteint à son tour, de manière irréversible. 97% des patients présentent une perte bilatérale de la vision en moins d’un an, et cette perte de vision est simultanée dans 25% des cas. La NOHL causerait la cécité visuelle chez environ 800-1 200 personnes par an aux Etats-Unis et en Europe.
À propos de LUMEVOQ® (GS010 ; lenadogene nolparvovec)
LUMEVOQ® (GS010 ; lenadogene nolparvovec) cible la neuropathie optique héréditaire de Leber (NOHL), et s’appuie sur une technologie propriétaire de séquence de ciblage mitochondrial (MTS), issue des travaux de l’Institut de la Vision à Paris, qui, lorsqu’elle est associée au gène d’intérêt, permet de l’adresser spécifiquement à l’intérieur de la mitochondrie grâce à un vecteur AAV (Adeno-Associated Virus). Le gène d’intérêt est ainsi transféré dans la cellule pour y être exprimé et produire la protéine fonctionnelle, qui sera acheminée à l’intérieur des mitochondries grâce aux séquences nucléotidiques spécifiques, afin de restaurer la fonction mitochondriale déficiente ou manquante. « LUMEVOQ » a été autorisé comme nom commercial pour le GS010 (lenadogene nolparvovec) par l’Agence Européenne des Médicaments (EMA) en octobre 2018.
À propos de REFLECT
REFLECT est une étude multicentrique, randomisée, en double aveugle, contrôlée versus placebo visant à évaluer l’efficacité et la tolérance des injections bilatérales de LUMVOQ® (GS010 ; lenadogene nolparvovec) chez des sujets atteints par la NOHL en raison de la mutation NADH déshydrogénase 4 (ND4).
L’essai a inclus 98 sujets ayant commencé à perdre la vision depuis moins d’un an, et est mené dans plusieurs centres en Europe, aux États-Unis et à Taïwan.
Dans le bras actif, LUMVOQ® a été administré en une seule injection intravitréenne dans les deux yeux de chaque sujet. Dans le bras placebo, LUMVOQ® a été administré en une seule injection intravitréenne dans le premier œil affecté, tandis que l’autre œil a reçu une injection placebo.
Le critère d’évaluation principal de l’étude REFLECT est l’acuité visuelle (Best Corrected Visual Acuity ou BCVA) mesurée en LogMAR 1,5 an après le traitement du deuxième œil affecté / non encore affecté. La variation par rapport à la baseline dans les deuxièmes yeux affectés / non encore affectés recevant LUMVOQ® et le placebo est le critère principal d’évaluation. Les critères d’efficacité secondaires incluent : BCVA mesurée en LogMAR 2 ans après le traitement du deuxième œil affecté / non encore affecté par rapport au placebo et au premier œil affecté recevant LUMVOQ®, OCT, sensibilité aux contrastes et échelles de qualité de vie. Le premier patient a été traité en mars 2018, et le dernier en juillet 2019.
Identifiants ClinicalTrials.gov :
REFLECT: NCT03293524
Contacts
-
Image7Communication et Relations PresseJulia Friedlander-Most / Romain Grière+33 (0)6 83 00 97 55 / +33 (0)7 86 53 17 29
-
LifeSci AdvisorsRelations InvestisseursGuillaume van Renterghem+41 (0)76 735 01 31
-
Orpheon FinanceInvestisseurs ParticuliersJames Palmer+33 7 60 92 77 74