- L’effet du traitement de LUMEVOQ® est maintenu 3 ans après l’administration du traitement, avec une acuité visuelle on‑chart de 1,26 LogMAR en moyenne
- Les scores de qualité de vie ont continué à s’améliorer entre 2 et 3 ans après l’administration du traitement
Paris, France, le 31 août 2021, 7h30 CEST – GenSight Biologics (Euronext : SIGHT, ISIN : FR0013183985, éligible PEA-PME), société biopharmaceutique dédiée au développement et à la commercialisation de thérapies géniques innovantes pour les maladies neurodégénératives de la rétine et du système nerveux central, annonce aujourd’hui que le Journal of Neuro-Ophthalmology (JNO) a publié les résultats de RESTORE, l’étude de suivi à long terme de LUMEVOQ®, qui montrent l’effet prolongé d’une injection unilatérale de LUMEVOQ® trois ans après administration dans les essais cliniques RESCUE et REVERSE.
L’article*, publié dans le numéro de septembre de JNO sous le titre « Long-Term Follow-Up After Unilateral Intravitreal Gene Therapy for Leber Hereditary Optic Neuropathy: The RESTORE Study » (Suivi à long terme après injection intravitréenne unilatérale de thérapie génique pour la neuropathie optique héréditaire de Leber : l’étude RESTORE) , présente des analyses montrant une amélioration soutenue de l’acuité visuelle (best-corrected visual acuity, BCVA) et des scores de qualité de vie trois ans après que les sujets ont reçu le traitement LUMEVOQ®. L’amélioration continue de l’acuité visuelle a été observée dans les deux yeux des patients traités unilatéralement, confirmant l’effet controlatéral du traitement rapporté dans les essais RESCUE et REVERSE.
«Il est prometteur de voir ce résultat maintenu», a commenté l’auteur principal Dr. Valérie Biousse, MD, Départements d’ophtalmologie, de neurologie et de chirurgie neurologique, Emory University School of Medicine, Atlanta, Etats-Unis. Le Dr Biousse, qui a également été co‑investigateur dans les essais RESCUE et REVERSE, a ajouté «C’est une preuve supplémentaire de l’effet thérapeutique bilatéral d’une seule injection unilatérale de thérapie génique.»
L’acuité visuelle moyenne s’est graduellement améliorée jusqu’à atteindre 1,26 LogMAR 48 mois après le début des symptômes (soit 3 ans après injection), tout en restant on-chart (c’est-à-dire meilleure que 1,6 LogMAR) tout au long de la période de suivi. Une analyse de régression LOESS (locally estimated scatterplot smoothing) illustre l’amélioration progressive et prolongée de l’acuité visuelle chez les sujets de RESTORE (Figure 1) après l’administration du traitement par LUMEVOQ®.
Figure 1. Évolution de l’acuité visuelle (BCVA) chez les sujets NOHL-ND4 ayant reçu une injection unilatérale de thérapie génique LUMEVOQ®
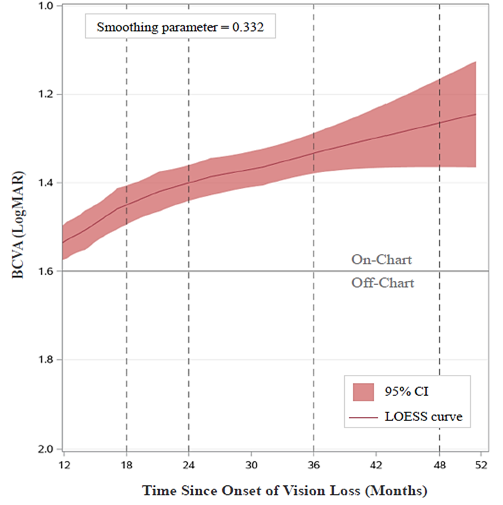
BCVA : best-corrected visual acuity (meilleure acuité visuelle corrigée), CI : confidence interval (intervalle de confiance) ; LOESS : locally estimated scatterplot smoothing, LogMAR: logarithme de la résolution minimale de l’angle, NOHL : neuropathie optique héréditaire de Leber. La courbe LOESS montre l’évolution de la BCVA dans tous les yeux (LUMEVOQ® et sham) de 12 à 51,5 mois après le début de la perte de vision. La courbe commence 12 mois après le début des symptômes, quand 92.7% des yeux dans RESCUE et REVERSE ont reçu le traitement, soit avec LUMEVOQ®, soit avec une injection simulée (sham).
Par ailleurs, la qualité de vie des sujets a continué de s’améliorer entre 2 et 3 ans après l’injection, comme rapporté par le questionnaire VFQ-25 sur la fonction visuelle. Comparé aux résultats avant traitement, le score composite moyen (qui correspond à la moyenne de 11 sous-échelles du VFQ-25 associées à la vision) s’est amélioré de 4 points 2 ans après traitement, et de 7 points à 3 ans. Trois ans après injection, une amélioration cliniquement significative par rapport aux scores pré-traitement a été observée dans les sous-échelles correspondant à la santé mentale (+21 points), aux difficultés de rôle (+17 points), à la dépendance (+15 points), à la vision générale (+9 points), aux activités proches (+6 points), et aux activités distantes (+5 points).
RESCUE et REVERSE étaient des essais cliniques de phase III randomisés, en double masqué, contrôlés par injection simulée, qui ont évalué l’efficacité et l’innocuité de la thérapie génique LUMEVOQ® dans le traitement de la perte de vision due à la NOHL-ND4. La seule différence entre les deux études était la durée de la perte de vision à l’inclusion dans l’étude: les sujets RESCUE avaient une perte de vision de moins de 6 mois, tandis que les sujets REVERSE avaient une perte de vision de 6 à 12 mois. Les 72 sujets ayant terminé les essais de phase III RESCUE et REVERSE ont été invités à participer à l’étude RESTORE, et 62 (86,1%) ont accepté d’être suivis jusqu’à cinq ans après traitement.
L’article est disponible en ligne sur : https://journals.lww.com/jneuro-ophthalmology/Fulltext/2021/09000/Long_Term_Follow_Up_After_Unilateral_Intravitreal.5.aspx .
*À propos de l’article:
Long-Term Follow-Up After Unilateral Intravitreal Gene Therapy for Leber Hereditary Optic Neuropathy: The RESTORE Study
Auteurs: Valérie Biousse, MD1, Nancy J. Newman, MD1, Patrick Yu-Wai-Man, MD, PhD2,3,4,5, Valerio Carelli, MD PhD6,7 , Mark L. Moster, MD8, Catherine Vignal-Clermont, MD9,10, Thomas Klopstock, MD11,12,13, Alfredo A. Sadun, MD, PhD14, Robert C. Sergott, MD8, Rabih Hage, MD10, Simona Esposti, MD4, Chiara La Morgia, MD, PhD6,7, Claudia Priglinger, MD15, Rustum Karanja, MD, PhD14,16, Laure Blouin, MSc17, Magali Taiel, MD17, José-Alain Sahel, MD, PhD10,18,19,20 for the LHON Study Group
Affiliations:
- Departments of Ophthalmology, Neurology and Neurological Surgery, Emory University School of Medicine, Atlanta, Georgia USA.
- Cambridge Centre for Brain Repair and MRC Mitochondrial Biology Unit, Department of Clinical Neurosciences, University of Cambridge, Cambridge, UK.
- Cambridge Eye Unit, Addenbrooke’s Hospital, Cambridge University Hospitals, Cambridge, UK.
- Moorfields Eye Hospital, London, UK.
- UCL Institute of Ophthalmology, University College London, London, UK.
- IRCCS Istituto delle Scienze Neurologiche di Bologna, Programma di Neurogenetica, Bologna, Italy.
- Unit of Neurology, Department of Biomedical and Neuromotor Sciences (DIBINEM), University of Bologna, Bologna, Italy.
- Departments of Neurology and Ophthalmology, Wills Eye Hospital and Thomas Jefferson University, Philadelphia, PA, USA.
- Department of Neuro Ophthalmology and Emergencies, Rothschild Foundation Hospital, Paris, France.
- Centre Hospitalier National d’Ophtalmologie des Quinze Vingts, Institut Hospitalo-Universitaire FOReSIGHT, INSERM-DGOS CIC 1423, Paris, France
- Department of Neurology, Friedrich-Baur-Institute, University Hospital, LMU Munich, 80336 Munich, Germany.
- German Center for Neurodegenerative Diseases (DZNE), Munich, Germany.
- Munich Cluster for Systems Neurology (SyNergy), Munich, Germany.
- Doheny Eye Institute / UCLA School of Medicine, Los Angeles, CA, USA
- Department of Ophthalmology, University Hospital, Ludwig-Maximilians-University (LMU) Munich, 80336 Munich, Germany
- Department of Ophthalmology, University of Ottawa Eye, Ottawa ON, Canada
- GenSight Biologics, Paris, France
- Sorbonne Université, INSERM, CNRS, Institut de la Vision, 75012 Paris, France
- Fondation Ophtalmologique A. de Rothschild, 25-29 rue Manin, 75019 Paris
- Department of Ophthalmology, The University of Pittsburgh School of Medicine, Pittsburgh, USA
À propos de GenSight Biologics
GenSight Biologics S.A. (GenSight Biologics) est une société biopharmaceutique dédiée au développement et à la commercialisation de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central. Le portefeuille de recherche de GenSight Biologics s’appuie sur deux plates-formes technologiques : le ciblage mitochondrial (Mitochondrial Targeting Sequence, ou MTS) et l’optogénétique, visant à préserver ou restaurer la vision chez les patients atteints de maladies neurodégénératives de la rétine. En utilisant son approche de thérapie génique, les candidats médicaments de GenSight Biologics sont destinés à offrir aux patients une récupération visuelle fonctionnelle durable après une seule injection intra-vitréenne dans chaque œil. Développé dans le traitement de la neuropathie optique héréditaire de Leber (NOHL), le principal produit candidat de GenSight Biologics, LUMEVOQ® (GS010 ; lenadogene nolparvovec), est actuellement en cours d’examen pour enregistrement en Europe, et en phase III préalablement au dépôt de la demande d’autorisation de mise sur le marché aux Etats-Unis (Biologics License Application [BLA]).
À propos de la Neuropathie Optique Héréditaire de Leber (NOHL)
La neuropathie optique héréditaire de Leber (NOHL) est une maladie mitochondriale rare, de transmission maternelle, caractérisée par une dégénérescence des cellules ganglionnaires de la rétine et provoquant en moins d’un an une perte brutale et irréversible de la vision conduisant généralement à la cécité légale. Ces symptômes apparaissent principalement chez les adolescents et les jeunes adultes. La NOHL provoque une perte brutale, soudaine et sans douleur de la vision centrale dans le 1er œil, puis le 2nd œil est atteint à son tour, de manière irréversible. 97% des patients présentent une perte bilatérale de la vision en moins d’un an, et cette perte de vision est simultanée dans 25% des cas. La NOHL causerait la cécité visuelle chez environ 1 200 personnes par an aux Etats-Unis et en Europe.
À propos de LUMEVOQ® (GS010)
LUMEVOQ® (GS010 ; lenadogene nolparvovec) cible la neuropathie optique héréditaire de Leber (NOHL), et s’appuie sur une technologie propriétaire de séquence de ciblage mitochondrial (MTS), issue des travaux de l’Institut de la Vision, qui, lorsqu’elle est associée au gène d’intérêt, permet de l’adresser spécifiquement à l’intérieur de la mitochondrie grâce à un vecteur AAV (Adeno-Associated Virus). Le gène d’intérêt est ainsi transféré dans la cellule pour y être exprimé et produire la protéine fonctionnelle, qui sera acheminée à l’intérieur des mitochondries grâce aux séquences nucléotidiques spécifiques, afin de restaurer la fonction mitochondriale déficiente ou manquante. « LUMEVOQ » a été autorisé comme nom commercial pour le GS010 (lenadogene nolparvovec) par l’Agence Européenne des Médicaments (EMA) en octobre 2018. LUMEVOQ® est actuellement en cours d’examen pour enregistrement en Europe, et en phase III préalablement au dépôt de la demande d’autorisation de mise sur le marché aux Etats-Unis (Biologics License Application [BLA]).
À propos de RESCUE, REVERSE et RESTORE
RESCUE et REVERSE sont deux études distinctes de Phase III randomisées, en double masqué, contrôlées par injection simulée (sham), conçues pour évaluer l’efficacité d’une injection intravitréenne unique de GS010 (rAAV2/2ND4) chez des sujets atteints de la NOHL induite par la mutation G11778A ND4.
Le critère d’évaluation principal mesure la différence d’efficacité de GS010 entre les yeux traités et les yeux non traités (sham), sur la base de l’acuité visuelle (Best Corrected Visual Acuity ou BCVA), mesurée à l’aide de l’échelle ETDRS à 48 semaines après injection. Les scores « Logarithm of the Minimal Angle of Resolution » des patients, ou LogMAR, qui sont dérivés du nombre de lettres lues sur l’échelle ETDRS, sont utilisés à des fins statistiques.
Les deux études ont été conçues pour évaluer une différence statistiquement significative d’au moins 15 lettres ETDRS entre les yeux traités et non-traités (sham), ajustés de l’acuité visuelle initiale (baseline).
Les critères d’évaluation secondaires incluent l’application de l’analyse principale aux yeux ayant reçu GS010 et présentant à l’inclusion la meilleure acuité visuelle initiale (« meilleur œil »), comparés à ceux ayant reçu la procédure sham, ainsi qu’aux yeux ayant reçu GS010 et présentant la moins bonne acuité visuelle initiale (« moins bon œil »), comparés à ceux ayant reçu la procédure sham. Également, une évaluation de la proportion de patients « répondeurs » est réalisée, incluant notamment le pourcentage de patients qui maintiennent leur acuité visuelle (perte de moins de 15 lettres ETDRS), le pourcentage de patients qui améliorent leur acuité visuelle de 15 lettres ETDRS, ainsi que le pourcentage de patients présentant une acuité visuelle finale >20/200. Les paramètres visuels mesurés incluent également les champs visuels automatisés, la tomographie par cohérence optique, ainsi que la sensibilité aux couleurs et aux contrastes, en plus des mesures de qualité de vie, de biodissémination, et de réponse immunitaire post-injection.
Les études ont été menées en parallèle, chez 37 patients pour REVERSE et 39 patients pour RESCUE, dans 7 centres aux États-Unis, au Royaume-Uni, en France, en Allemagne et en Italie. Les résultats à 96 semaines de suivi des deux études ont été publiés en 2019. Les patients ont ensuite été transférés vers une étude de suivi à long terme pour 3 années supplémentaires.
L’objectif principal est d’évaluer la sécurité à long terme d’une injection intravitréenne de LUMEVOQ® jusqu’à 5 ans après le traitement. L’objectif secondaire est d’évaluer l’efficacité à long terme du traitement ainsi que la qualité de vie des sujets pendant 5 ans après le traitement. Le premier sujet a été recruté le 9 janvier 2018, et 61 sujets ont été recrutés.
Identifiants ClinicalTrials.gov :
REVERSE: NCT02652780
RESCUE: NCT02652767
RESTORE: NCT03406104
Contacts
-
Image7Communication et Relations PresseJulia Friedlander-Most / Romain Grière+33 (0)6 83 00 97 55 / +33 (0)7 86 53 17 29
-
LifeSci AdvisorsRelations InvestisseursGuillaume van Renterghem+41 (0)76 735 01 31
-
Orpheon FinanceInvestisseurs ParticuliersJames Palmer+33 7 60 92 77 74