- Efficacité maintenue deux ans après injection : amélioration statistiquement significative de l’acuité visuelle par rapport à la baseline et au nadir dans les yeux traités par LUMEVOQ®
- 73% des patients traités bilatéralement ont gagné au moins 15 lettres ETDRS par rapport à leur nadir
- Meilleure efficacité chez les sujets traités bilatéralement, associée à un profil de tolérance favorable
Paris, France, le 14 décembre 2021, 7h30 CET – GenSight Biologics (Euronext : SIGHT, ISIN : FR0013183985, éligible PEA-PME), société biopharmaceutique spécialisée dans le développement et la commercialisation de thérapies géniques innovantes pour les maladies neurodégénératives rétiniennes et les troubles du système nerveux central, annonce aujourd’hui des résultats d’efficacité et de tolérance à 2 ans post-injection de LUMEVOQ® dans l’essai clinique de phase III REFLECT. Les résultats montrent le maintien de l’efficacité et de la tolérance d’une injection intravitréenne bilatérale de la thérapie génique, et notamment une meilleure efficacité par rapport à une injection unilatérale.
Ces analyses confirment les résultats à 18 mois après administration du traitement, rapportés en juin 2021.
« La démonstration par l’étude REFLECT d’une amélioration soutenue, significative, et sûre de l’acuité visuelle chez les patients atteints de NOHL traités bilatéralement avec LUMEVOQ® donne un élan supplémentaire à notre volonté d’obtenir l’autorisation de mise sur le marché », a déclaré Bernard Gilly, Directeur Général et Co-fondateur de GenSight Biologics. « Les patients atteints de NOHL et qui perdent la vue méritent d’avoir accès à un traitement comme LUMEVOQ®. »
Conçu dans le cadre d’un Special Protocol Assessment (SPA) avec la FDA, REFLECT est un essai de phase III randomisé, double-masqué, et contrôlé par une injection de placebo, qui inclut 98 sujets présentant une perte de vision due à la Neuropathie Optique Héréditaire de Leber (NOHL) causée par une mutation du gène mitochondrial ND4 ; et dont la durée de perte de vision à l’inclusion dans l’étude était de moins d’un an. La mutation mitochondriale ND4 est associée à la forme clinique la plus grave de NOHL, avec de mauvais pronostics visuels.1 Tous les sujets ont reçu une injection intravitréenne (IVT) de LUMEVOQ® dans leur premier œil affecté. Le deuxième œil affecté a été randomisé pour une deuxième IVT de LUMEVOQ® ou de placebo, administrée le jour-même ou le lendemain. 48 sujets ont été randomisés dans le bras de traitement bilatéral par LUMEVOQ®, et 50 dans le bras de traitement unilatéral par LUMEVOQ® (premier œil affecté traité par LUMEVOQ®, deuxième œil affecté traité par placebo).
Amélioration significative de l’acuité visuelle par rapport à la baseline, avec de meilleurs résultats chez les patients injectés bilatéralement
Deux ans après injection, l’acuité visuelle (best-corrected visual acuity, BCVA) moyenne dans les yeux traités par LUMEVOQ® était statistiquement et significativement meilleure qu’à baseline, tandis que l’amélioration par rapport à la baseline n’était pas statistiquement significative dans les yeux traités par placebo. Les résultats indiquent un effet du traitement maintenu dans le temps, et une amélioration plus importante chez les patients traités bilatéralement.
Tableau 1 : Variation de l’acuité visuelle (BCVA) par rapport à la baseline, 2 ans après injection
| 1er œil affecté | 2ème œil affecté | |
| Sujets ayant reçu une injection bilatérale de LUMEVOQ® | LUMEVOQ®
–0,25 LogMAR p=0,0006 |
LUMEVOQ®
-0,18 LogMAR p=0,01 |
| Sujets injectés unilatéralement avec LUMEVOQ® | LUMEVOQ®
-0,16 LogMAR p=0,02 |
PLACEBO
-0,10 LogMAR p=0,1 (NS) |
L’effet controlatéral de LUMEVOQ® observé dans les yeux traités par placebo à 2 ans est cohérent avec celui qui a été documenté dans les yeux traités par injection simulée (sham injection) dans les essais REVERSE2 et RESCUE3.
Graphique 1. Évolution de l’acuité visuelle (BCVA) par rapport à la baseline (LogMAR) – Groupes d’yeux
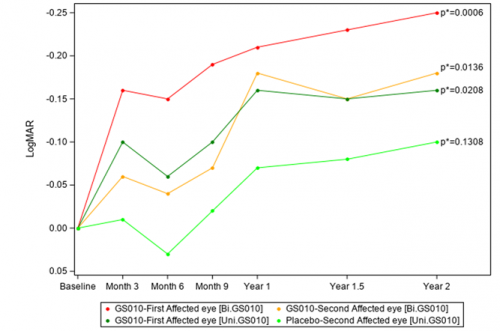
Remarques : Évolution par rapport à la valeur LogMAR à baseline. Les moyennes des moindres carrés (Least Squares) ont été estimées à l’aide de modèles mixtes, ajustés sur la valeur à baseline, avec des valeurs répétées pour chaque patient. Les valeurs p* ont été calculées par rapport à baseline.
Les analyses à 2 ans confirment également l’effet dose qui a été observé à 18 mois : l’acuité visuelle moyenne à 2 ans était de 1,32 et 1,44 LogMAR respectivement chez les sujets traités bilatéralement et unilatéralement, avec une différence absolue entre les deux bras de +6 lettres ETDRS, en faveur des sujets traités bilatéralement.
L’analyse des répondeurs met en évidence le bénéfice du traitement pour les patients qui auraient autrement connu une perte de vision importante, avec une très faible probabilité de récupération spontanée.1 Par exemple, 60% des patients traités bilatéralement (56 % des patients traités unilatéralement) qui avaient une vision supérieure au seuil de cécité légale dans au moins un œil sont restés au-dessus de ce seuil à 2 ans.
Efficacité démontrée de façon plus marquée avec l’amélioration de l’acuité visuelle par rapport au nadir
La comparaison avec le nadir (c’est-à-dire la moins bonne valeur de BCVA collectée entre la baseline et 2 ans post-traitement) démontre encore plus clairement l’efficacité de LUMEVOQ®, y compris dans les yeux traités par placebo qui se sont améliorés via un effet controlatéral du traitement.
Tableau 2 : Variation de l’acuité visuelle (BCVA) par rapport au nadir 2 ans après injection
| 1er œil affecté | 2ème œil affecté | |
| Sujets ayant reçu une injection bilatérale de LUMEVOQ® | LUMEVOQ
–0.39 LogMAR p<0,0001 |
LUMEVOQ
-0,34 LogMAR p<0,0001 |
| Sujets injectés unilatéralement avec LUMEVOQ® | LUMEVOQ
-0,38 LogMAR p<0,0001 |
PLACEBO
-0,27 LogMAR p<0,0001 |
Les analyses des répondeurs indiquent que l’effet du traitement ne se limite pas à une minorité de sujets. Deux ans après injection, 73 % des sujets traités bilatéralement et 66 % des sujets traités unilatéralement ont connu une amélioration cliniquement significative d’au moins -0,3 LogMAR (+15 lettres ETDRS) par rapport à leur nadir.
Tableau 3 : Analyses des répondeurs basées sur la variation par rapport au nadir à 2 ans
| Définition du répondeur | Amélioration de -0,3 LogMAR dans au moins un œil | Récupération cliniquement pertinente (CRR)
dans au moins un œil |
| Sujets ayant reçu une injection bilatérale de LUMEVOQ® | 73% | 75% |
| Sujets injectés unilatéralement avec LUMEVOQ® | 66% | 60% |
Remarque : La récupération cliniquement pertinente (Clinically Relevant Recovery, CRR) est définie comme suit : i) Pour les yeux on-chart au nadir, une amélioration de ≤ -0,2 LogMAR (≥10 lettres ETDRS) par rapport au nadir ; ou ii) Pour les yeux off-chart au nadir, une progression on-chart (c.-à-d. une BCVA ≤ 1,6 LogMAR).
L’injection bilatérale a un profil de tolérance favorable
Le profil de tolérance favorable de LUMEVOQ® a été confirmé. Il n’y a pas eu d’interruption de l’étude liée à un événement indésirable systémique ou oculaire, et aucun événement indésirable oculaire grave n’a été rapporté. Le principal événement indésirable oculaire était l’inflammation intraoculaire, la plupart du temps d’intensité légère et répondant au traitement conventionnel. Le bon profil de tolérance de LUMEVOQ® était comparable chez les sujets traités unilatéralement et bilatéralement.
« La persistance de l’efficacité de LUMEVOQ est remarquablement cohérente dans l’ensemble du programme de développement, de sorte que les résultats de REFLECT renforcent les preuves fournies par 3 ans de données de RESTORE4 et 5 ans de données de REVEAL », a déclaré Magali Taiel, MD, Chief Medical Officer de GenSight Biologics.
Les résultats du suivi à 4 ans de RESTORE devraient être disponibles en janvier 2022.
Le Dr Taiel a ajouté : « Nous affirmons que l’injection bilatérale de LUMEVOQ® est la meilleure option pour les patients atteints de Neuropathie Optique Héréditaire de Leber porteurs d’une mutation ND4. »
Les patients de REFLECT ont été invités à participer à un suivi à long terme qui évaluera la tolérance et l’efficacité de LUMEVOQ® jusqu’à 5 ans après injection.
Références :
- Newman NJ, Carelli V, Taiel M, Yu-Wai-Man P. Visual outcomes in Leber hereditary optic neuropathy subjects with the m.11778G>A (MTND4) mitochondrial dna mutation. J Neuroophthalmol. (2020) 40:547–57. doi: 10.1097/WNO.0000000000001045.
- Yu-Wai-Man P, Newman NJ, Carelli V, Moster ML, Biousse V, Sadun AA, et al. Bilateral visual improvement with unilateral gene therapy injection for Leber hereditary optic neuropathy. Sci Transl Med. (2020) 12:eaaz7423. doi: 10.1126/scitranslmed.aaz7423
- Newman NJ, Yu-Wai-Man P, Carelli V, Moster ML, Biousse V, Vignal-Clermont C, et al. Efficacy and safety of intravitreal gene therapy for Leber hereditary optic neuropathy treated within 6 months of disease onset. Ophthalmology. (2021) 128:649–60. doi: 10.1016/j.ophtha.2020.12.012.
- Biousse V, Newman NJ, Yu-Wai-Man P, Carelli V, Moster ML, Vignal-Clermont C, et al. Long-term follow-up after unilateral intravitreal gene therapy for Leber hereditary optic neuropathy: The RESTORE study. J Neuroophthalmol. (2021) 41:309-315.
Contacts
-
Image7Communication et Relations PresseJulia Friedlander-Most / Romain Grière+33 (0)6 83 00 97 55 / +33 (0)7 86 53 17 29
-
LifeSci AdvisorsRelations InvestisseursGuillaume van Renterghem+41 (0)76 735 01 31
-
Orpheon FinanceInvestisseurs ParticuliersJames Palmer+33 7 60 92 77 74